多癌种Carcimun检测的前瞻性、单盲评估
介绍
通过早期诊断和癌症筛查早期及时发现恶性肿瘤,可以使患者有机会更有效地从癌症治疗中获益。迄今为止的研究显示,癌症早期阶段的治疗和干预,其治疗反应和生存率改善更为明显[1]。近年来结直肠癌和乳腺癌等一些癌症死亡率的下降,至少可以部分归因于相应的癌症早期筛查试验的建立[2]。
然而,目前绝大多数癌症患者仍然是在肿瘤晚期出现症状后被诊断的,此时肿瘤多已经进展到治疗手段选择有限的程度。癌症筛查的诊断工具现今仅用于少数几种癌症,包括结合显微镜下病理检查结合DNA检测宫颈癌[3]、皮肤检查[4]、成像技术[乳腺癌乳房x线摄影[5]、计算机断层摄影(CT)和结肠镜[6]胸部低剂量CT[7]、基于血液的检查[例如前列腺特异性抗原[8]、癌胚抗原[9]以及液体活检等方法检测循环肿瘤细胞和肿瘤衍生DNA[10-11]。然而,这些检测中的许多都受到相当低的灵敏度和特异性的限制,分别为70%~80%和大约60%~70%[12]。此外,其敏感性还取决于肿瘤的大小、患者的年龄、病史和肿瘤组织组成[13-15]。
目前,大多数癌症筛查策略都集中在某种特定肿瘤,这与癌症流行病学的“悖论”相矛盾。癌症流行病学认为,人一生中患任何癌症的风险通常都很高,而患某种特定癌症的风险在特定时间相当低[12]。因此,如果能在临床上具有足够的敏感性、特异性、准确性以及适用性和可及性的基础上,那么一种更泛用的可用于早期诊断、检测多种常见肿瘤实体的检测将对癌症管理具有最高的意义[16]。
大多数用于癌症早期诊断的体外诊断试验都是基于检测肿瘤衍生蛋白或突变以及显示肿瘤恶性的其他固有变化。相比之下,本研究中提出的Carcimun检测(由Berthold Zwerger发明)是基于这样一种结论,即在给定波长下的人血浆的光学吸收光谱变化可能具有诊断意义[17],因为病理条件下可检测到其特定的改变[18],这为癌症的早期筛查提供了机会[19-20]。在Carcimun检测中,血浆样本将基于标准化流程被处理和检测,以揭示与恶性肿瘤相关的改变。然而,诱导这种现象的分子机制仍有待阐明。有趣的是,在未发表的初步研究中,我们发现Carcimun检测结果不仅与恶性肿瘤相关,而且与急性和慢性炎症相关,这表明体液免疫系统也可能参与其中[21]。这些初步研究的数据表明,如果可以排除急性炎症,在确定阈值以上的消光度改变可以提示患者患有恶性肿瘤。
从长远来看,我们认为Carcimun检测可能应用于两种临床情景。首先,我们假设该检测可作为无症状个体的筛查工具。其次,这项检测可能对早期诊断癌症是可行的,在出现初始症状和不明确的临床体征后,它的阳性结果有提示性意义。为了进一步验证第二个假设,我们进行了一项前瞻性、单盲性评估,这包括对病理学证实为恶性疾病的患者和健康志愿者的全因死亡率进行5年随访。我们依照STARD报告标准撰写了本论文(参见 https://pcm.amegroups.com/article/view/10.21037/pcm-21-35/rc)。
材料和方法
试验设计
本项前瞻性、单中心、单盲研究于2015年4月~2016年4月在奥地利维也纳医科大学进行,随后进行了5年随访分析。这项研究是根据《赫尔辛基宣言》(2013年修订)进行的。该研究已获得维也纳医科大学机构伦理委员会(No.EK 1651/2015,奥地利维也纳医科大学)批准,所有患者均已获得其知情同意。
试验参与者
研究参与者的样本来自奥地利维也纳医科大学普外科的部分患者。根据解剖学资料和病理学检查(即接受过癌症手术治疗的患者),参与者被分为癌症患者组和健康志愿者组。为了纳入研究,参与者需要提供书面的知情同意。主要排除标准为:在进行Carcimun检测前14天内存在急性和慢性炎症、发热、自身免疫性疾病和其他不适感,以及是否进行过造影剂和同位素检查和/或任何治疗干预。如果一级排除标准的满足存在不确定性,则进一步对参与者进行白细胞数量和C反应蛋白和纤维蛋白原水平的检测(二级排除标准)。
B Zwerger和J Groth的一项未发表的初步研究结果显示,“Zwerger检测”(也命名为Carcimun检测)的准确性约为89%(特异性和敏感性)。我们的零假设是,在研究队列中,“Zwerger检测”检测恶性疾病样本的敏感性和特异性均不低于89%。样本量计算假设准确率为89%,置信区间为5%,表明总队列规模n=302是合适的。这一估计对研究队列中50%的阳性(恶性)样本是有效的。所有计算均按照Jones等人[22]发表的公式进行。
Carcimun检测方法及随访
在Carcimun检测中,每个参与者从肘静脉中抽取一份9 mL血液样本,并保存入K3-EDTA管中用于血浆制备,3.2%缓冲柠檬酸钠用于标准凝血分析。血浆获取后立即离心(3000 rpm,5 min,室温),并转移到无添加剂的试管中。所有血浆样本在测试前都是盲法。由于正在进行的专利申请过程,无法提供其后的Carcimun检测流程的细节。简而言之,根据标准化的方案,特定的生物化学过程变化导致了特定血浆蛋白的构象变化,并使用了商业临床化学分析仪Thermo Scientific Konelab PRIME 60对其进行光学评估。所有样品都以同样的流程进行分析,测量结果以毫秒消光单位表示。然后将健康人群(£120)和癌症患者(0>120)的检测阈值被设为120。到达随访时间后,通过电话采访评估每个健康志愿者后续癌症的发生情况,如果无法进行电话随访,则检查随访者最新的可用医疗记录。在奥地利死亡登记处进行了进一步筛查,以发现死亡者(全因死亡率)。
统计分析
正态分布的人口统计学资料(年龄)的组间差异比较采用未配对样本t检验,并以均数±标准差(SEM)表示。采用卡方检验性别比例和吸烟状况的组间差异。交叉表用于分析测试性能(特异性、敏感性、准确性、阳性预测值和阴性预测值)。根据实际测试性能(真阳性、真阴性、假阳性和假阴性的比率),我们使用交叉表计算出了偶然商。使用n=307的样本量和显著性水平α=0.05进行事后功效检验。为评估肿瘤分期对消光度水平的影响,将4种实体瘤(乳腺、胰腺、结肠直肠、肛门)每分期类别的消光度水平计算平均值并按肿瘤分期分层。并采用单因素logistic回归分析。由于每个类别的病例数均较低,所以本次亚组分析的数据以平均值的形式呈现(不进行组间比较)。生存曲线采用Kaplan-Meier估计法计算。所有统计分析均使用SPSS 26(IBM Corp,USA)进行。
结果
纳入研究者的特征
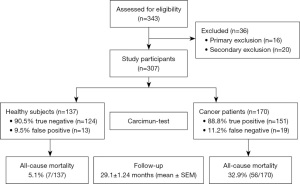
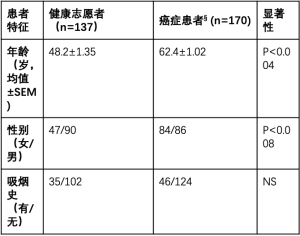
在筛选的343名研究的参与者中,分别有16名(4.66%)和20名(5.83%)参与者因不满足一级和二级排除标准而被排除。其余307名研究参与者在研究开始时都进行了Carcimun试验,包括137名健康志愿者和170名被证实为恶性肿瘤的癌症患者(图1)。平均随访时间为29.1±1.24(SEM)个月(范围为0~61.9个月)。表1总结了平均年龄、性别比例和吸烟状况。癌症患者的恶性肿瘤诊断在抽血前通过活检证实或在抽血后通过手术切除病变证实。
Full table
测试结果的总体差异
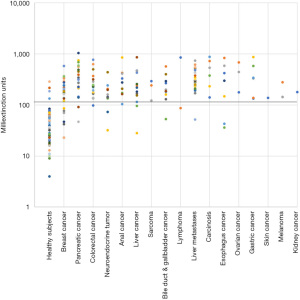
癌症患者的平均消光值明显高于健康个体(表2)。与研究参与者的整体和正确识别个体的亚组相比,癌症患者的平均消光值分别增加了4.4倍和6.7倍。此外,乳腺癌、大肠癌、胰腺癌和肛门癌患者的消光值(包括假阴性)与肿瘤的分期呈正相关(表3)。样本在未见视觉可见的明显变化,如大量蛋白质沉淀等。

Full table

Full table
Carcimun检测结果鉴定癌症患者
在小型试点研究的基础上,定义了临界值120,以区分健康个体(£120)和癌症患者(>120)。应用这一临界值,Carcimun检测正确识别了89.6%的研究参与者(275/307)为健康个体(124/137)或不同种类的癌症患者(151/170)。这些数据与之前未发表的初步研究结果相一致。健康人群中有9.5%(13人)的检测结果为假阳性,癌症患者中有11.2%(19人)的检测结果为假阴性(图1-图2)。假阴性结果分别出现在以下肿瘤病例中:乳腺癌Ⅰ期(12例中有4例)、Ⅱ期(9例中有2例)、Ⅲ期(4例中有1例)、Ⅳ期(2例中有0例)、胰腺癌Ⅱ期(1例中有0例)、Ⅲ期(9例中有1例)、Ⅳ期(11例中有1例)、食管癌Ⅱ期和Ⅳ期;肝癌(n=2)、胆管癌(n=3)、神经内分泌肿瘤(n=2)、结直肠癌Ⅰ期(0/2)、Ⅱ期(0/3)、Ⅲ期(0/5)、Ⅳ期(1/8)、肝转移癌(n=1)、淋巴瘤(n=1)。
Carcimun检测的性能评估
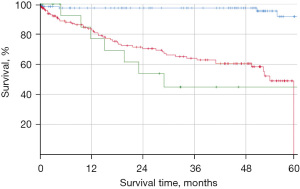
在我们的研究中,Carcimun检测取得了较高的准确性(90.0%)、敏感性(88.8%)和特异性(91.2%)。阳性预测值为92.0%,阴性预测值为87.0%。事后功效分析计算显示功效为1.0,第2类错误的可能性为0%。为了研究Carcimun检测结果的临床相关性,我们评估了被正确识别为健康个体或癌症患者的研究参与者的5年全因死亡率(图3)。5年后,健康个体的全因死亡率低于10%,癌症患者的全因死亡率超过50%(P<0.002)。然而,被检测为阳性(真阳性)或阴性(假阴性)的癌症患者的生存曲线相似,表明该试验确实遗漏了临床相关的癌症(图3)。虽然在进行Carcimun检测的采血过程中没有观察到不良事件,但参考流程是临床常见标准工作的一部分,其与公认的一些不良事件有关。
讨论
在这项研究中,我们评估了新型Carcimun检测在区分癌症患者和健康志愿者中的可行性和效能。Carcimun检测在临床实践中很容易应用,并成功地区分了健康受试者和癌症患者,且具有较高的准确性、敏感性和特异性。Carcimun检测结果还与长期生存相关,这支持了Carcimun检测的临床相关性。
癌变过程中癌基因的激活和抑癌基因的丢失不仅直接决定了癌细胞的特性,而且深刻影响着肿瘤与宿主的相互作用,其涉及免疫系统的激活或抑制,以及整体免疫系统和局部免疫环境与转移的相互关系[23]。Carcimun检测的确切生物学机制目前尚不清楚。然而,我们认为,与评估特定肿瘤蛋白和突变存在的传统肿瘤标志物和筛选方法相比,Carcimun检测评价的是在人血浆中可检测到的宿主癌症防御机制的反应。这些机制可能涉及肿瘤细胞与宿主免疫系统的相互作用。这可能会导致免疫系统血浆蛋白的微妙变化。这些蛋白的修饰和改变可能是Carcimun检测的原理,并会导致血浆蛋白在给定波长[24,25]的光吸收度变化。为了证明这一假设,目前的研究考虑了以下观察结果和两种可能的解释。正如本文报道的,我们观察到Carcimun检测的消光度测量结果显示与疾病阶段有很强的相关性。在第一个也是最常见的场景中,我们将其解释蛋白质沉淀和/或增溶过程对消光度的调节。显然,沉淀或增溶现象会改变散射量和吸收分子质量,这将对消光度产生直接影响。考虑到我们检测到的消光度的显著变化,我们应该预期随着肿瘤分期的增加,会有显著的、光学可见的蛋白质沉淀或溶解。然而,事实并非如此。因此,我们可以否认沉淀现象是所观察到的消光度变化的主要分子原理。在第二种情况下,在一个定义的波长上观察到的消光度变化是由于几个光吸收最大值的移动合并到波长上,在这个波长上进行吸收测量。第二种情况与我们的观察结果一致,即吸收增加时没有沉淀,但提出了可能导致消光度最大值发生这种变化的潜在分子现象的问题。一般来说,芳香基团如色氨酸、酪氨酸或苯丙氨酸以及芳香辅助因子主导着生物分子样品的光吸收行为。这些基团中的每一个都有一个特征吸收最大值,并经常被其环境调节[24,25]。
由于这种可能更普遍的潜在现象,我们在本文中展示的Carcimun检测能够检测广泛的肿瘤实体,在癌症筛查和早期诊断方面比传统方法具有明显优势。Carcimun检测的另一个优点是,它提供了一种系统的、可靠的方法来检测癌症,从而使其临床应用成为可能。本文数据进一步表明,该方法具有较高的敏感性(88.8%)和特异性(91.2%),甚至超越了许多常规癌症筛查试验(12项)的性能,如胰腺癌CA199试验[敏感性:70%~90%;特异性:68%~91%[26],乳腺造影增强光谱检查[敏感性:85%,特异性:77%[27],大肠癌的粪便免疫化学检查[敏感性:79%,特异性:94%[28]。然而,Carcimun检测的假阳性和假阴性结果的数量仍然值得关注。假阳性的检测结果会将健康受试者误认为患有该疾病,并造成严重的心理暗示影响,以及不必要的、可能是侵入性的诊断或治疗手段。假阴性测试结果将癌症患者误认为没有患病,会给他们一种错误的安全感,并可能阻止他们采用额外的诊断手段,从而拖延癌症诊断。并且在早期治疗提供更好的康复机会的情况下,其延迟诊断可能使发病率和死亡率的风险增加。为了改进这些不足,我们的目标是完全了解分子机制的测试并进一步提高测试性能。此外,定期(例如每年)进行Carcimun检测可以降低错误检测结果的风险,特别是因为我们的研究结果表明,在乳房、结肠、胰腺和肛门癌中,Carcimun检测的平均消光度与肿瘤分期呈正相关。然而,在目前的时间点上,我们认为Carcimun检测是对其他诊断工具的补充,而不是完全替代。
Carcimun检测的一个主要缺点可能是需要排除研究参与者的炎症。由于存在炎症体征而被排除在本研究之外的个体数量相对较少,因此,如果在出现首发症状和临床体征的患者中应用Carcimun检测进行癌症早期检测,这一缺陷可能可以忽略不计。显然,这一缺点在其作为无症状个体的筛查工具应用时更为明显。我们正在进行更多的研究,以进一步提高Carcimun检测在这种情况下的性能。
在我们的研究中,两个研究组人口统计学特征的显著差异可能会限制结果的泛化性。然而,在这项研究中,我们的目的是评估我们试验的临床可行性和一般性能。因此,除了上述基础研究之外,我们还将开展更大规模、设计合理的研究,以进一步评价Carcimun检测在诊断和筛查性能。
结论
目前用于筛查和早期发现癌症的大多数肿瘤标志物和诊断方法只能识别特定肿瘤类型的存在。此外,许多癌症筛查策略的敏感性和特异性不理想,一些方法的临床可行性有限。借助Carcimun检测,我们提出了一种新颖的、临床可行的方法来检测广泛的肿瘤类型,具有高特异性、敏感性和准确性。目前,我们认为Carcimun检测是对现有诊断工具的一种潜在补充,而不是替代品。进一步的研究将需要描述Carcimun检测的分子机制,并证明Carcimun检测在癌症筛查和早期诊断中的临床可行性。
Acknowledgments
Funding: This study was privately funded by Berthold von und zu Zwerger.
Footnote
Reporting Checklist: The authors have completed the STARD reporting checklist. Available at https://pcm.amegroups.com/article/view/10.21037/pcm-21-35/rc
Data Sharing Statement: Available at https://pcm.amegroups.com/article/view/10.21037/pcm-21-35/dss
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at https://pcm.amegroups.com/article/view/10.21037/pcm-21-35/coif). WV serves as an unpaid editorial board member of Precision Cancer Medicine from June 2020 to May 2022. WV received consulting fees from Siemens Healthineers for non-study related projects. BZ reports that this study was privately funded by himself. The other author has no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved. The study was conducted in accordance with the Declaration of Helsinki (as revised in 2013). The study was approved by Institutional Ethics Committee of Medical University of Vienna (EK 1651/2015, Medical University of Vienna, Austria) and informed consent was taken from all the patients.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin 2018;68:7-30. [Crossref] [PubMed]
- Byers T, Wender RC, Jemal A, et al. The American Cancer Society challenge goal to reduce US cancer mortality by 50% between 1990 and 2015: Results and reflections. CA Cancer J Clin 2016;66:359-69. [Crossref] [PubMed]
- Tsikouras P, Zervoudis S, Manav B, et al. Cervical cancer: screening, diagnosis and staging. J BUON 2016;21:320-5. [PubMed]
- Wolff T, Tai E, Miller T. Screening for skin cancer: an update of the evidence for the U.S. Preventive Services Task Force. Ann Intern Med 2009;150:194-8. [Crossref] [PubMed]
- van den Biggelaar FJ, Nelemans PJ, Flobbe K. Performance of radiographers in mammogram interpretation: a systematic review. Breast 2008;17:85-90. [Crossref] [PubMed]
- Pickhardt PJ, Hassan C, Halligan S, et al. Colorectal cancer: CT colonography and colonoscopy for detection--systematic review and meta-analysis. Radiology 2011;259:393-405. [Crossref] [PubMed]
- Hoffman RM, Sanchez R. Lung Cancer Screening. Med Clin North Am 2017;101:769-85. [Crossref] [PubMed]
- Brawer MK. Prostate-specific antigen. Semin Surg Oncol 2000;18:3-9. [Crossref] [PubMed]
- Young GP, Pedersen SK, Mansfield S, et al. A cross-sectional study comparing a blood test for methylated BCAT1 and IKZF1 tumor-derived DNA with CEA for detection of recurrent colorectal cancer. Cancer Med 2016;5:2763-72. [Crossref] [PubMed]
- Li J, Guan X, Fan Z, et al. Non-Invasive Biomarkers for Early Detection of Breast Cancer. Cancers (Basel) 2020;12:2767. [Crossref] [PubMed]
- Liu MC, Oxnard GR, Klein EA, et al. Sensitive and specific multi-cancer detection and localization using methylation signatures in cell-free DNA. Ann Oncol 2020;31:745-59. [Crossref] [PubMed]
- Schiffman JD, Fisher PG, Gibbs P. Early detection of cancer: past, present, and future. Am Soc Clin Oncol Educ Book 2015;57-65. [Crossref] [PubMed]
- Humphrey LL, Deffebach M, Pappas M, et al. Screening for lung cancer with low-dose computed tomography: a systematic review to update the US Preventive services task force recommendation. Ann Intern Med 2013;159:411-20. [Crossref] [PubMed]
- Ohuchi N, Suzuki A, Sobue T, et al. Sensitivity and specificity of mammography and adjunctive ultrasonography to screen for breast cancer in the Japan Strategic Anti-cancer Randomized Trial (J-START): a randomised controlled trial. Lancet 2016;387:341-8. [Crossref] [PubMed]
- Sprague BL, Arao RF, Miglioretti DL, et al. National Performance Benchmarks for Modern Diagnostic Digital Mammography: Update from the Breast Cancer Surveillance Consortium. Radiology 2017;283:59-69. [Crossref] [PubMed]
- Shapley M, Mansell G, Jordan JL, et al. Positive predictive values of ≥5% in primary care for cancer: systematic review. Br J Gen Pract 2010;60:e366-77. [Crossref] [PubMed]
- Meinke M, Müller G, Helfmann J, et al. Optical properties of platelets and blood plasma and their influence on the optical behavior of whole blood in the visible to near infrared wavelength range. J Biomed Opt 2007;12:014024. [Crossref] [PubMed]
- Bosschaart N, Kok JH, Newsum AM, et al. Limitations and opportunities of transcutaneous bilirubin measurements. Pediatrics 2012;129:689-94. [Crossref] [PubMed]
- Franklin RG, Sanigar EB, Allen AJ. Spectrographic Studies of Cancer and Normal Blood Plasma: II. Absorption Spectra of Fractionated Cancer and Normal Human Blood Plasma. The American Journal of Cancer 1936;27:301-7. [Crossref]
- Lawaetz AJ, Bro R, Kamstrup-Nielsen M, et al. Fluorescence spectroscopy as a potential metabonomic tool for early detection of colorectal cancer. Metabolomics 2012;8:111-21. [Crossref]
- Adam JK, Odhav B, Bhoola KD. Immune responses in cancer. Pharmacol Ther 2003;99:113-32. [Crossref] [PubMed]
- Jones SR, Carley S, Harrison M. An introduction to power and sample size estimation. Emerg Med J 2003;20:453-8. [Crossref] [PubMed]
- Wellenstein MD, de Visser KE. Cancer-Cell-Intrinsic Mechanisms Shaping the Tumor Immune Landscape. Immunity 2018;48:399-416. [Crossref] [PubMed]
- Fiallo MM, Kozlowski H, Garnier-Suillerot A. Mitomycin antitumor compounds. Part 1. CD studies on their molecular structure. Eur J Pharm Sci 2001;12:487-94. [Crossref] [PubMed]
- Kemp W. Ultraviolet and Visible Spectroscopy. Organic Spectroscopy. London: Macmillan Education UK, 1991:243-83.
- Zhou B, Xu JW, Cheng YG, et al. Early detection of pancreatic cancer: Where are we now and where are we going? Int J Cancer 2017;141:231-41. [Crossref] [PubMed]
- Suter MB, Pesapane F, Agazzi GM, et al. Diagnostic accuracy of contrast-enhanced spectral mammography for breast lesions: A systematic review and meta-analysis. Breast 2020;53:8-17. [Crossref] [PubMed]
- Lee JK, Liles EG, Bent S, et al. Accuracy of fecal immunochemical tests for colorectal cancer: systematic review and meta-analysis. Ann Intern Med 2014;160:171. [Crossref] [PubMed]
韩沛朕
复旦大学附属肿瘤医院(更新时间:2023-05-05)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Salat A, Voigt W, von und zu Zwerger B. Prospective and single-blinded evaluation of the multi-cancer Carcimun-test. Precis Cancer Med 2022;5:12.