普拉替尼治疗RET突变的非小细胞肺癌:系列病例
背景介绍
靶向治疗的出现彻底改变了具有致癌驱动基因变异的非小细胞肺癌(NSCLC)的治疗格局[1,2]。研究表明,与化疗相比,靶向治疗可显著改善患者的预后以及生活质量。因此,酪氨酸激酶抑制剂(TKI)已成为具有EGFR、ALK、BRAF和ROS-1[3-6]突变患者的临床标准治疗。
二代测序(NGS)等新型分子诊断工具有助于发现更多致癌驱动因素。转染重排(rearranged during transfection,RET)、HER2、c-MET外显子14跳跃突变、KRASG12C突变和NTRK已被确定为NSCLC患者的新型分子靶点。
研究证实RET基因重排可发生在1%~2%的肺腺癌中,尤其是在年轻和不吸烟的患者中[12-14]。普拉替尼是一种具有强效抗RET活性的口服酪氨酸激酶抑制剂。一项多中心和多队列试验显示,61%的先前接受铂类化疗的患者和70%的初治患者获得了客观缓解[15]。基于这些结果,美国食品药品监督管理局(FDA)于2020年9月加速批准普拉替尼用于治疗转移性RET融合阳性NSCLC。专家组和国际指南推荐普拉替尼作为RET融合阳性的转移性NSCLC患者的一线或后续治疗选择[16]。此外,塞尔帕替尼(一种ATP竞争性、高选择性的RET激酶小分子抑制剂)的疗效也在已经接受过其他治疗和未接受过治疗的患者中得到证实,客观缓解率分别为64%和85%[17]。
在意大利,允许已经接受过其他治疗的RET融合突变的NSCLC患者接受普拉替尼的恩慈治疗。目前相关临床试验正在评估普拉替尼作为转移性或不能切除的局部晚期NSCLC的一线用药的可行性[18,19]。最近的一份报告显示了普拉替尼作为RET融合突变的NSCLC患者的新辅助治疗用药的成功性[20]。
由于RET融合的稀有性和相关靶向治疗药物的新颖性,目前“真实世界”数据存在较大的空缺。我们报告了4例RET突变的NSCLC患者接受普拉替尼治疗的临床病例。据我们所知,这是用普拉替尼治疗RET融合突变的转移性NSCLC的第一个临床系列案例报告。
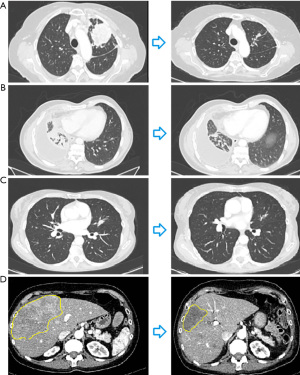
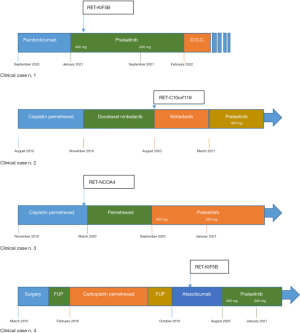
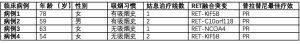
表1总结了不同患者的临床特征,图1为患者接受普拉替尼治疗前后的影像学改变,图2为患者的治疗时间线以及相关分子特征。相关病例的护理报告核对表见于以下网址:https://pcm.amegroups.com/article/view/10.21037/pcm-21-50/rc。
Full table
病例汇报
案例一
患者,高加索女性,78岁,有吸烟史,于2020年7月被诊断出患有转移性肺腺癌。PD-L1免疫组织化学(IHC)在肿瘤标本中的阳性比例为70%。未检测到EGFR、ALK和ROS1基因的可操作突变。一线治疗予以帕博丽珠单抗200 mg,每3周一次。三个月后,计算机断层扫描(CT)显示胸膜疾病进展,基因检测(Foundation Medicine、Cambridge、MA、USA)结果提示存在RET-KIF5B融合突变。因此,患者于2021年1月起开始服用普拉替尼400 mg/d,呼吸道症状迅速改善,治疗过程中出现轻度高血压和运动障碍,但未停药或减少给药剂量。2021年3月,CT显示肺部结节和胸膜病变均明显缩小,评价疗效为部分缓解(PR)(图1A)。2021年9月,由于反复发作的黏膜炎和疲劳,药物剂量减少至200 mg/d。末次复查时间为2022年1月,CT扫描显示病情稳定。患者于2022年2月死于心血管事件,死亡原因与肿瘤和普拉替尼治疗无直接关系。
案例二
患者,高加索男性,59岁,有吸烟史,于2019年8月被诊断为肺腺癌,伴有肺、淋巴结、肾上腺和腹膜转移。一线予以铂类为基础的双药化疗4个周期后出现疾病进展。2019年11月予多西紫杉醇联合尼达尼布的二线化疗,疾病得到有效控制。肿瘤组织基因检测(Foundation Medicine)提示该患者存在RET-C10orf118融合突变。2021年3月,复查CT提示病情进展,予普拉替尼400 mg,1次/d单药治疗。治疗3个月后CT提示疾病部分缓解(图1B)。截至2022年4月,患者病情稳定,并且未出现任何药物相关不良反应。
案例三
患者,高加索女性,63岁,无吸烟史,于2019年8月被诊断出患有肺腺癌,并且伴有多发性骨转移。基因检测未发现药物相关靶点,PD-L1 IHC结果显示其肿瘤细胞阳性比例为3%。2019年11月开始给予顺铂联合培美曲塞治疗,完成4个周期后复查CT,提示疾病部分缓解,后患者继续使用培美曲塞进行维持治疗。2020年9月复查骨显像显示疾病进展,停用培美曲塞。对患者的液体活检标本行二代测序,结果提示RET-NCOA4融合突变,遂予以普拉替尼400 mg/d。2020年12月复查CT示疾病部分缓解。治疗5个月后,患者出现尺骨鹰嘴滑囊炎、黏膜炎和4级中性粒细胞减少 根据常见不良事件评价标准(CTCAE)v5]。由于上述副作用,患者停用普拉替尼,恢复治疗后将普拉替尼的剂量减少至200 mg/d。2022年4月,患者无其他重大毒性反应,继续使用普拉替尼治疗,影像学提示疾病稳定(图1C)。
案例四
患者,高加索女性,54岁,于2015年3月因肺腺癌接受左上叶切除术。术后予以顺铂联合吉西他滨的辅助化疗及放射治疗。2017年12月,PET CT扫描显示肺部病灶复发,可见多发淋巴结和骨转移。肿瘤细胞PD-L1 IHC阳性比例为10%,基因检测结果提示EGFR、ALK和ROS1为野生型。一线化疗予以卡铂联合培美曲塞,并对骨转移病灶行姑息性放疗。一线化疗失败后,给予阿替丽珠单抗免疫治疗。2020年6月,液体活检标本二代测序结果提示患者存在RET-KIF5B融合突变。2020年8月,CT提示疾病广泛进展,予普拉替尼靶向治疗。在治疗过程中,患者出现药物相关不良反应,包括3级中性粒细胞减少、2级贫血,减少药物剂量至200 mg/d。复查CT,评价疗效为部分缓解(图1D)。2022年4月的患者仍在接受治疗,维持疾病稳定,未见明显药物相关不良反应。
本研究中进行的所有程序都符合机构和(或)国家研究委员会的道德标准以及《赫尔辛基宣言》(2013年修订)。患者的亲属/父母签署了相关的知情同意书,同意书的副本可供本刊编辑部审阅。由于手稿为非实验性内容,当地伦理委员会不需要批准。
讨论
在过去的几十年中,靶向治疗极大地改变了NSCLC的治疗格局,而二代测序等新型分子诊断工具的出现有助于我们发现更多的致癌驱动靶点。其中,RET融合突变在NSCLC中较为罕见,但其被视为TKI的有效靶点。最新证据显示塞尔帕替尼和普拉替尼具有强大的抗肿瘤作用,其作用机制与靶向EGFR、ALK和ROS1突变的TKI类似[3,4,6,15,17]。目前二代测序在临床实践中并未广泛普及,只有少数临床诊治中心常规开展相关靶点检测。并且在某些国家,普拉替尼和塞尔帕替尼尚未被批准成为RET融合突变阳性NSCLC患者的标准治疗药物,因此有关这些药物“真实世界”的疗效数据目前仍处于缺失状态。
这些临床案例证明了以RET融合突变情况为依据为NSCLC患者定制个性化治疗方案的重要性。我们发现,所有患者在化疗或免疫治疗失败后均接受了普拉替尼治疗,并且取得了显著的临床获益和持久的肿瘤缓解。3例患者经历了导致剂量减少的药物相关不良反应,但没有1例患者永久停止治疗。为了探索和评估普拉替尼用于治疗RET融合突变NSCLC患者的有效性和缓解率,需要进一步行多中心多样本的大规模临床研究。
我们发现真实世界中患者的无进展生存期以及相关的临床获益情况与临床试验结果相一致[21]。
总结
尽管本病例报告规模较小,但这份报告指出了研究和靶向RET融合突变在NSCLC中的重要意义。我们从本研究中观察到接受普拉替尼治疗的患者获得了显著的临床益处和持久的客观缓解,但TKIs治疗RET融合阳性NSCLC的有效率目前缺乏大型临床试验数据支持,需要大规模研究来进一步探索和评估。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the editorial office, Precision Cancer Medicine, for the series “Uncommon Mutations in Non-Small Cell Lung Cancer”. The article has undergone external peer review.
Reporting Checklist: The authors have completed the CARE reporting checklist. Available at https://pcm.amegroups.com/article/view/10.21037/pcm-21-50/rc
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at https://pcm.amegroups.com/article/view/10.21037/pcm-21-50/coif). The series “Uncommon Mutations in Non-Small Cell Lung Cancer” was commissioned by the editorial office without any funding or sponsorship. MR served as the unpaid Guest Editor of the series and serves as an unpaid editorial board member of Precision Cancer Medicine from August 2020 to July 2022. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved. All procedures performed in this study were in accordance with the ethical standards of the institutional and/or national research committee(s) and with the Helsinki Declaration (as revised in 2013). Informed consents were obtained from the patients’ relatives/parents. A copy of the written consent is available for review by the editorial office of this journal. Local ethics committee approval was not required due to non-experimental content of the manuscript.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Yuan M, Huang LL, Chen JH, et al. The emerging treatment landscape of targeted therapy in non-small-cell lung cancer. Signal Transduct Target Ther 2019;4:61. [Crossref] [PubMed]
- König D, Savic Prince S, Rothschild SI. Targeted Therapy in Advanced and Metastatic Non-Small Cell Lung Cancer. An Update on Treatment of the Most Important Actionable Oncogenic Driver Alterations. Cancers (Basel) 2021;13:804. [Crossref] [PubMed]
- Peters S, Camidge DR, Shaw AT, et al. Alectinib versus Crizotinib in Untreated ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2017;377:829-38. [Crossref] [PubMed]
- Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer. N Engl J Med 2018;378:113-25. [Crossref] [PubMed]
- Planchard D, Smit EF, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously untreated BRAFV600E-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol 2017;18:1307-16. [Crossref] [PubMed]
- Shaw AT, Riely GJ, Bang YJ, et al. Crizotinib in ROS1-rearranged advanced non-small-cell lung cancer (NSCLC): updated results, including overall survival, from PROFILE 1001. Ann Oncol 2019;30:1121-26. [Crossref] [PubMed]
- Tsuta K, Kohno T, Yoshida A, et al. RET-rearranged non-small-cell lung carcinoma: a clinicopathological and molecular analysis. Br J Cancer 2014;110:1571-8. [Crossref] [PubMed]
- Ekman S. HER2: defining a Neu target in non-small-cell lung cancer. Ann Oncol 2019;30:353-5. [Crossref] [PubMed]
- Liang H, Wang M. MET Oncogene in Non-Small Cell Lung Cancer: Mechanism of MET Dysregulation and Agents Targeting the HGF/c-Met Axis. Onco Targets Ther 2020;13:2491-510. [Crossref] [PubMed]
- Arbour KC, Rizvi H, Plodkowski AJ, et al. Treatment Outcomes and Clinical Characteristics of Patients with KRAS-G12C-Mutant Non-Small Cell Lung Cancer. Clin Cancer Res 2021;27:2209-15. [Crossref] [PubMed]
- Haratake N, Seto T. NTRK Fusion-positive Non-small-cell Lung Cancer: The Diagnosis and Targeted Therapy. Clin Lung Cancer 2021;22:1-5. [Crossref] [PubMed]
- Takeuchi K, Soda M, Togashi Y, et al. RET, ROS1 and ALK fusions in lung cancer. Nat Med 2012;18:378-81. [Crossref] [PubMed]
- Kohno T, Ichikawa H, Totoki Y, et al. KIF5B-RET fusions in lung adenocarcinoma. Nat Med 2012;18:375-7. [Crossref] [PubMed]
- Hess LM, Han Y, Zhu YE, et al. Characteristics and outcomes of patients with RET-fusion positive non-small lung cancer in real-world practice in the United States. BMC Cancer 2021;21:28. [Crossref] [PubMed]
- Gainor JF, Curigliano G, Kim DW, et al. Pralsetinib for RET fusion-positive non-small-cell lung cancer (ARROW): a multi-cohort, open-label, phase 1/2 study. Lancet Oncol 2021;22:959-69. [Crossref] [PubMed]
- Login @ Www.Nccn.Org. Available online: https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf
- Drilon A, Oxnard GR, Tan DSW, et al. Efficacy of Selpercatinib in RET Fusion-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2020;383:813-24. [Crossref] [PubMed]
- A Study Evaluating the Efficacy and Safety of Multiple Therapies in Cohorts of Participants with Locally Advanced, Unresectable, Stage III Non-Small Cell Lung Cancer (NSCLC). [cited 2022 Apr 27]. Available online: https://www.clinicaltrials.gov/ct2/show/NCT05170204?term=PRALSETINIB&draw=2&rank=6
- A Study of Pralsetinib Versus Standard of Care for First-Line Treatment of Advanced Non-Small Cell Lung Cancer (NSCLC). [cited 2022 Apr 27]. Available online: https://www.clinicaltrials.gov/ct2/show/NCT04222972?term=PRALSETINIB&draw=2&rank=4
- Zhou N, Li T, Liang M, et al. Use of Pralsetinib as Neoadjuvant Therapy for Non-Small Cell Lung Cancer Patient With RET Rearrangement. Front Oncol 2022;12:848779. [Crossref] [PubMed]
- Curigliano G, Gainor JF, Griesinger F, et al. Safety and efficacy of pralsetinib in patients with advanced RET fusion-positive non-small cell lung cancer: Update from the ARROW trial. J Clin Oncol 2021;39:9089. [Crossref]
贾茜雅
复旦大学附属肿瘤医院(更新时间:2023-05-05)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Galletti A, Russano M, Citarella F, Di Fazio G, Santo V, Brunetti L, Vincenzi B, Tonini G, Santini D. RET-mutated non-small cell lung cancer treated with pralsetinib: a case series. Precis Cancer Med 2022;5:20.