
非转移性去势抵抗性前列腺癌的过去、现在和未来:叙述性回顾
介绍
背景
前列腺癌(PCa)是全球男性中第二大常见恶性肿瘤,2020年估计有1,414,259例新确诊病例和375,304例死亡[1]。尽管对于何时开始和停止筛查血清前列腺特异性雄激素(PSA)水平没有共识,美国国立综合癌症网络(NCCN)指南仍建议使用其来作为早期PCa的筛查[2]。由于这种机会性筛查,PCa的发病率自20世纪90年代初以来急剧增加[3]。2000~2007年期间诊断的患者的5年相对生存率为84.6%,仅次于睾丸肿瘤[4]。这也解释了为什么男性中最常见的癌症是PCa,全世界的患病率估计为1,193,715[1]。
由于PSA筛查项目的推广,早期PCa诊断的数量有所增加,允许通过手术或放疗进行局部治疗。然而,经过10年随访,27%~53%的患者出现生化复发(BCR)。BCR最普遍接受的定义是:根治性前列腺切除术后经第二次检测证实的PSA高于或等于0.2 ng/mL,或放疗后PSA高于最低点2 ng/mL或更高,常规影像学无转移证据[5-7]。
BCR的最佳治疗取决于多种因素,如PSA水平、PSA倍增时间(PSA−DT)、患者偏好和合并症。雄激素剥夺治疗(ADT)已被广泛使用,对于特定的患者是一个选择。然而,早期采取ADT的好处尚不清楚,延长ADT可能会降低心肺健康,并增加心血管死亡的风险。许多医生为高危BCR患者使用ADT方案,特别是那些PSA−DT<6个月的患者[7,8]。一项回顾性研究探讨了806例在前列腺根治术后出现BCR和PSA−DT<10个月的男性患者延迟ADT直至出现转移的结果。结果显示中位无转移生存期(MFS)为192个月,总生存期(OS)为204个月。该研究进一步认为,在这种情况下使用ADT缺乏有意义的证据,需要与患者讨论后做决定[9]。基于同样的条件,其他系统性治疗也正在探索,包括免疫治疗、化疗、新的激素制剂和聚(adp-核糖)聚合酶(PARP)抑制剂。TAX3503是一项Ⅲ期试验,将根治性治疗后高危BCR患者随机分组接受ADT或ADT+多西他赛治疗,这是第一次在这种情况下显示出结果的试验。多西他赛组中未观察到无进展生存期(PFS)(危险比(HR)=0.8;95%CI:0.61~1.04)或OS(HR=0.51;95%CI:0.23~1.10)在统计学上的获益[7,10]。
随访5年内,约10%~20%的PCa患者对ADT产生耐药性,逐渐发展为去势抵抗性前列腺癌(CRPC)。尽管采用了传统的标准疗法,但转移性去势抵抗性前列腺癌(mCRPC)的中位生存期仍不到3年[11]。欧洲泌尿外科协会(EAU)指南将CRPC定义为去除率血清睾酮<50 ng/dL或1.7 nmol/L加上以下一种进展类型:生化进展(定义为至少间隔一周的PSA连续3次升高,导致最低点上升50%,PSA水平>2 ng/mL),或放射学进展(骨扫描发现的两个或两个以上骨病变,或使用实体T肿瘤反应评估标准(RECIST)发现的软组织病变)。大多数患者在达到这种状态(mCRPC)时已经发生了转移,并且近年来其治疗发展迅速。然而,一些患者在常规成像(骨扫描和胸腹骨盆横断面成像)上没有转移的征象。这些患者被称为非转移性去势抵抗性前列腺癌(nmCRPC),其中约30%的患者会在2年内发生远处转移。尽管存在这种风险,但在2018年之前,没有任何治疗方案能够提高这些患者的OS[12-14]。
对于无症状的nmCRPC男性,PCa晚期复发放射检查(RADAR)指南建议每3个月进行一次PSA检测,当PSA达到2ng /mL时进行常规影像学评估,当PSA达到5ng/mL时再次进行评估,当PSA加倍时再次进行评估[15]。
然而,并不是所有的患者都会有相同的进展。nmCRPC是一种高异质性疾病,从惰性状态到转移迅速发展的状态。一项评估201例nmCRPC患者MFS的研究发现,基线PSA水平(高于10 ng/mL)和PSA速度是较短的首次骨转移时间、MFS和OS的独立危险因素。另外,一项在nmCRPC中使用地舒单抗的大型Ⅲ期随机试验证实,≤10个月的PSA−DT预测更短的OS和无骨转移生存期(BMFS)。这些结果支持在这种情况下使用PSA−DT来分辨高危患者[16,17]。
本文的目的是对nmCRPC进行有效地分析。我们的目标是在2018年之前描述nmCRPC和治疗方案,并详细分析批准用于该疾病的三种药物的Ⅲ期临床试验。我们还将根据新的成像技术和分子生物标志物讨论这一疾病的新兴状态。
目的
本文旨在概述nmCRPC的定义,并总结2018年之前的治疗方案。我们还分析了三个Ⅲ期临床试验,基于这些试验已经批准的三个治疗方案,并显示出对nmCRPC患者OS的影响。此外,我们还讨论了新型成像技术对nmCRPC诊断和治疗的潜在影响,以及基于分子亚型指导治疗方案的可能性。我们根据叙述审查报告清单(可在https:// pcm.amegroups.com/article/view/10.21037/pcm-21-34/rc)呈现以下文章。
方法
这是一篇叙述性综述。用“非转移性去势抵抗性前列腺癌”(nmCRPC)的关键词在PubMed数据库检索2005~2021年的文献。我们回顾和总结了目前关于nmCRPC的定义、诊断和治疗的文献(表1)。我们排除了非英文文章和非Ⅱ期或Ⅲ期临床试验。
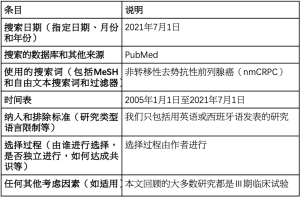
Full table
讨论
我们回顾了所有的文章并总结了重要发现。由于2018年之前大部分可用的治疗方法没有经过随机临床试验的测试,所以在寻找可用的治疗方法方面存在局限性。我们强调了最近三个对nmCRPC的管理产生重大影响的Ⅲ期临床试验。我们还总结了三个试验中最重要的间接比较。然而,需要直接比较才能确定对个别患者的最佳治疗方法。
2018年之前的治疗方案
在2018年之前,基于上述研究,nmCRPC通过观察或不同的方法进行管理,如去除或添加第一代雄激素受体(AR)抑制剂,使用酮康唑或皮质类固醇。由于这些治疗只显示出PSA反应,对OS没有任何影响,2019年之前的NCCN指南建议对PSA−DT>10个月的患者继续观察,对于PSA−DT≤10个月的患者,考虑到进展风险高,将他们纳入临床试验[18,19]。
额外的激素处理
CRPC最常见的生理病理是在低血清睾酮环境下AR转录的重新激活,这转化为PSA升高。长期以来,医生试图通过调节激素治疗的时间和方式来延长nmCRPC中的激素反应时间[18]。虽然nmCRPC主要由AR再激活驱动,但在2Ⅱ期试验中,额外的激素处理在短期内显示了适度的PSA反应,没有进一步的益处[20](表2)。
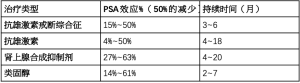
Full table
骨骼靶向治疗
到目前为止,骨骼是PCa中最常见的转移部位。因此,大量研究评估了骨靶向治疗在延缓nmCRPC男性骨转移出现中的作用[20]。
在一项Ⅲ期随机双盲试验中,508例名nmCRPC男性患者随机接受氯膦酸盐(第一代双膦酸盐)或安慰剂治疗。中位随访近10年,未观察到BMFS或OS获益[21]。另一项Ⅲ期试验在非选定人群中随机抽取201例nmCRPC男性患者分别接受唑来膦酸、第二代双膦酸盐或安慰剂治疗。由于中期分析显示骨转移发生率低于预期,试验在应计期结束前终止[22]。
内皮素−1(ET−1)和内皮素−A(ETA)受体在PCa进展中关系密切。阿曲生坦和齐博腾坦是强ETA受体拮抗剂。两个Ⅲ期随机、双盲、安慰剂对照试验评估了它们延缓nmCRPC骨转移的能力。在一项有941例患者参与的试验中研究了阿曲生坦在nmCRPC中的作用。阿曲生坦治疗的中位进展时间(TTP)延迟了93天,但差异无统计学意义(P=0.288)。OS也无差异[22]。在一项安慰剂对照试验中,1421例nmCRPC患者随机接受齐博腾坦或安慰剂治疗。中期分析时,OS无显著差异(HR=1.13;95%CI:0.73~1.76;P=0.589)或PFS(HR=0.89;95%CI:0.71~1.12;P=0.330)。鉴于这些结果,试验提前结束[23]。
RANK配体(RANKL)似乎影响破骨细胞的生存和功能,在骨微环境中似乎被肿瘤细胞上调。地舒单抗是一种RANKL抑制剂,在一项Ⅲ期随机试验中进行研究。共有1 432名患有nmCRPC的男性被随机分配到地舒单抗或安慰剂。需要强调的是,这是首次使用PSA−DT选择转移风险较高的人群的研究。地舒单抗显著增加BMFS,中位值为29.5,而不是25.2个月(HR=0.85:95%CI:0.73~0.98;P=0.028)。尽管如此,两组间的总生存时间没有差异,地舒单抗组的中位生存时间为43.9个月,安慰剂组的中位生存时间为44.8个月(HR=1.01:95%CI:0.85~1.20:P=0.91)[24]。尽管地舒单抗组的BMFS有一定的提高,但由于对OS没有益处,监管机构拒绝批准地舒单抗用于nmCRPC的治疗[18]。
免疫治疗
PSA−TRICOM是一种新型载体PSA疫苗。在一项Ⅱ期试验中,42例nmCRPC男性患者随机接受PSA−TRICOM与尼鲁米特单药治疗。疫苗组的OS有改善趋势(5.1年VS3.4年),但无统计学意义(P=0.13)[25]。
普罗文奇是一种在PCa中激活T细胞对抗抗原前列腺酸性磷酸酶的疫苗。FDA批准用于无内脏转移的无症状mCRPC。在一项纳入18例患者的小型研究中,评估了它对nmCRPC的疗效。大约70%的患者治疗后PSA−DT时间更长(7.9个月 vs. 4.9个月,P=0.09)。然而,没有患者PSA下降≥50%。没有进行临床试验[26]。
第二代抗雄激素药物
第二代AR拮抗剂比第一代AR拮抗剂更有效,而且如果AR过表达,除非存在一些特定的AR点突变,否则不能作为部分激动剂[27,28]。
由于nmCRPC的生存期延长,确定OS的替代终点至关重要。2011年的肿瘤药物咨询委员会(ODAC)会议讨论了这种情况下可能的临床试验终点。MFS被认为是一个合理的终点。MFS被理解为从随机分组到常规影像学发现远处转移或因任何原因死亡的时间,以先发生者为准[19]。MFS已被证明与PCa的OS和生活质量相关[29-31]。FDA批准MFS作为nmCRPC的一个可接受的临床试验终点,因为它可以延迟症状的出现[27]。
恩杂鲁胺
恩杂鲁胺以高亲和力(比比卡鲁胺大5-8倍)结合到AR的配体结合域,抑制雄激素的结合。它也抑制AR转位到细胞核及其与DNA的结合。与比卡鲁胺相比,恩杂鲁胺在去势耐受环境中的异种移植模型中没有表现出激动剂活性[27]。
美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)批准恩杂鲁胺用于多西他赛治疗前后mCRPC的治疗,两项Ⅲ期临床试验显示恩杂鲁胺可显著延长OS[32,33]。该研究是一项Ⅱ期、双盲、随机试验,在396例nmCRPC或mCRPC患者中比较恩杂鲁胺和比卡鲁胺疗效。恩杂鲁胺增加PFS的中位值为19.4个月,比卡鲁胺增加5.7个月(HR=0.24:95%CI:0.18~0.32:P<0.001)。所有预先指定的亚组均受益于恩杂鲁胺治疗,包括非转移性患者[34]。虽然这项研究并不支持OS,但这些发现为研究在疾病早期阶段使用第二代AR拮抗剂奠定了基础[35]。
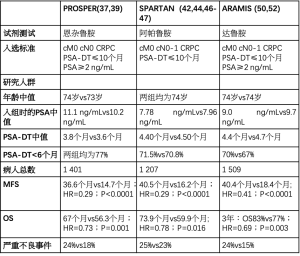
PROSPER试验是一项Ⅲ期、随机、双盲、安慰剂对照试验。共纳入了1 401例高危nmCRPC患者(定义为PSA−DT≤10个月和PSA水平≥2 ng/mL)。随机分组后,933例患者接受恩扎鲁胺治疗(160 mg,每天一次),468例患者在继续ADT的同时接受安慰剂治疗。根据PSA−DT进行分层(≥6个月或<6个月)和骨靶向药物的使用(是或否)。该试验包括在局部治疗后出现BCR的男性以及未接受局部治疗的男性[36]。
两臂具有相似的基线特征。研究开始时,恩扎鲁胺组的平均基线PSA水平为11.1 ng/mL,安慰剂组为10.2 ng/mL。PSA−DT分别为3.8个月和3.6个月。MFS是主要结果。评估的次要终点是首次使用后续抗肿瘤治疗的时间、PSA进展的时间、生活质量评估、OS和安全性[36]。
中位随访时间为22个月,恩扎鲁胺组的中位MFS为36.6个月,安慰剂组为14.7个月(HR=0.29;95%CI:0.24~0.35;P<0.001)。MFS的改善在所有患者亚组中都是一致的,包括PSA−DT(<6个月或≥6个月)。恩扎鲁胺组首次使用后续抗肿瘤治疗的时间为39.6个月,安慰剂组为17.7个月(HR=0.21:95%CI:0.17~0.26:P<0.001)。与安慰剂相比,恩扎鲁胺延长了PSA进展的时间(37.2个月和3.9个月,HR=0.07,P<0.001)[36]。
患者接受恩扎鲁胺治疗的时间中位数为18.4个月,安慰剂治疗的时间为11.1个月。与安慰剂组相比,恩扎鲁胺组报告的3级或以上不良事件(AEs)比例更高,最常见的是疲劳。恩扎鲁胺组中更常见的特殊不良事件包括高血压(12% VS. 5%)、主要心血管不良事件(5% VS. 3%)、精神障碍(5% VS. 2%)和非病理性骨折引起的跌倒(17% VS. 8%)[36]。然而,恩扎鲁胺并未恶化健康相关的生活质量(HRQOL)。事实上,它现实在几个领域显著降低了HRQOL临床意义恶化的风险,这可能是由于在MFS中观察到的益处[37]。
在第一次中期分析中,除OS外,所有主要和次要终点均符合显著性标准,OS在两组中均未达到中位数。因此,所有这些终点的分析都被认为是最终的,并且该试验是无盲的。安慰剂组的患者允许接受恩扎鲁胺(87例最初分配给安慰剂的患者接受恩扎卢胺)。根据这项研究,FDA和EMA分别于2018年和2019年批准了恩扎鲁胺治疗高危nmCRPC[36,38]。
最终分析显示OS有统计学意义的益处(HR=0.73:95%CI:0.61~0.89;P=0.001)。恩杂鲁胺组的中位OS为67个月,而安慰剂组为56.3个月。恩扎鲁胺和安慰剂的中位治疗时间分别为33.9个月和14.2个月,无新的不良事件报告。调整暴露后,3级或以上不良事件的发生率没有显著差异(恩扎鲁胺组为17/100患者年VS安慰剂组为20/100患者年)[38]。
在一项按年龄和地区分组的OS和安全性的后期分析中,恩杂鲁胺在不同地理区域和所有年龄的OS获益相似(HR=0.73:95%CI:0.58~0.9;对于年龄≥70岁的患者)(HR=0.72;95%CI:0.5~1.04;年龄<70岁者)。安全性在年龄组和地理区域是一致的。在这项多变量分析中,出现了3个显著影响OS的因素:东部合作肿瘤组(ECOG)的表现状态(1vs0;HR=1.7;95%CI:1.4~2.1;P<0.0001),PSA(HR=1.2:95%CI:1.1~1.3:P<0.0001),以及后续治疗的使用情况(是VS否;HR=2.5;95%CI:2.1~3.1;P<0.0001)[39]。
阿帕鲁他胺
阿帕鲁他胺是一种非甾体抗雄激素药物,是AR抑制剂雄激素结合域的竞争性结合剂。它还能抑制AR转位到细胞核、AR与DNA结合以及AR相关基因的转录。阿帕鲁他胺已被证明可以拮抗AR介导的信号传导,即使在AR过表达的CRPC细胞系中。在CRPC小鼠异种移植中,阿帕鲁他胺诱导的肿瘤消退优于比卡鲁他胺或恩杂鲁胺。在一项Ⅱ期研究中,高风险nmCRPC(定义为PSA水平≥8 ng/mL或PSA-DT≤10个月)患者在继续ADT的同时接受了阿帕鲁他胺(240 mg/d)。12周PSA反应率(定义为基线后PSA下降≥50%)为89%[40]。
这些结果引领了SPARTAN Ⅲ期双盲、随机、安慰剂对照试验的设计,涉及nmCRPC和PSA-DT≤10个月的男性。如果短轴<2 cm且位于主动脉分叉(N1)以下,患者可能患有病理性盆腔淋巴结。共有1207名男性按2:1的比例随机接受阿帕鲁他胺(240 mg/d)联合ADT(806例患者)或安慰剂(401例患者)。在放射学进展时,两组患者均可接受赞助商提供的醋酸阿匹龙加强的松。根据PSA-DT(>6 VS.≤6个月)、保留骨药物的使用情况以及有无恶性淋巴结(N0vsN1)进行分层[41]。
两组的基线特征平衡良好。大多数患者有N0疾病(83.5%的患者使用阿帕鲁他胺,83.8%的患者使用安慰剂)。在两组中,76.6%的患者曾接受过局部治疗,71%的患者PSA-DT≤6个月。在阿帕鲁他胺组和安慰剂组中,PSA-DT中位数分别为4.4个月和4.5个月,PSA中位数水平分别为7.78ng/mL和7.96 ng/mL[42]。
通过中心评估的主要终点为MFS。阿帕鲁他胺组中位MFS为40.5个月,而安慰剂组为16.2个月(HR=0.28:95%CI:0.23~0.35;P<0.001)。在所有预先指定的亚组中,阿帕鲁他胺的疗效都是一致的。在一项事后分析中,所有年龄组的患者在使用阿帕鲁他胺后MFS均有显著改善,与治疗相关的AEs发生率相似。75岁及以上患者的MFS HR为0.41(95%CI:0.31~0.56;P<0.0001),65~75岁患者的HR为0.24(95%CI:0.18~0.34;P<0.0001),65岁以下患者的HR为0.14(95%CI:0.07~0.27:P<0.0001)[41-42]。
在第一个中期分析中,阿帕鲁他胺在次级终点,如转移时间(HR=0.28;95%CI:0.23~0.34;P<0.0001)、PFS(HR=0.30;95%CI:0.25~0.36:P<0.0001)以及到症状进展的时间(HR=0.45:95%CI:0.32~0.63;P<0.0001)也显示出显著改善。基于这些结果,独立数据和安全监测委员会一致建议揭开这项研究的面纱。结果,76例最初接受安慰剂治疗的患者(19%)随后接受了阿帕鲁他胺治疗[41-43]。
首次中位随访20.3个月的OS中期分析显示了良好的结果,但没有达到统计学意义(HR=0.70;95%CI:0.47~1.04;P=0.0742)[36]。在第二次中期分析中,中位随访时间为41个月,155例(19.3%)患者因阿帕鲁他胺组进展而放弃治疗,而安慰剂组为210例(52.8%)。阿帕鲁他胺组85例(10.6%)患者因AEs导致治疗中断,安慰剂组28例(7%)患者因AEs导致治疗中断。阿帕鲁他胺和安慰剂的严重AE发生率相当(24.8% VS. 23.1%),分别有10例死亡和1例死亡。最常见的AE为疲劳(30.4% VS. 21.1%)、皮疹(23.8% VS. 5.5%)、跌倒(15.6% VS. 9%)、骨折(11.7% VS. 6.5%)、甲状腺功能减退(8.1% VS. 2%)和癫痫(0.2% VS. 9%)[43]。阿帕鲁他胺对HRQOL没有不利影响[44]。
第二个PFS(PFS2)是本试验的一个探索性终点,定义为从随机化到研究者评估疾病进展(通过PSA、影像学或症状的出现)在下列治疗或任何原因死亡后的时间。在第一次分析中,阿帕鲁胺组的PFS2显著长于安慰剂组(HR=0.49;95%CI:0.36~0.66)[41]。额外随访1年后,重新评估PFS2和安全性。中位随访时间为32个月,51.3%的阿帕鲁他胺组患者,8%的患者从安慰剂过渡到阿帕鲁他胺,99.7%的安慰剂组患者停止了研究治疗。在这些患者中,60%的阿帕鲁他胺组患者和79%的安慰剂组患者随后开始了mCRPC的全身治疗。最常见的后续全身治疗是阿比拉特罗(阿帕鲁胺组44%和安慰剂组58%)、恩扎鲁胺(分别为6.6%和10%)和多西紫杉醇(分别为4.9%和5.6%)。与安慰剂组的39.3个月(HR=0.5;95%CI:0.39~0.63;P<0.0001)相比,随机接受阿帕鲁胺治疗的患者的PFS2持续显著增加,但中值未达到安慰剂组。未观察到阿帕鲁胺组治疗相关不良事件(TRAE)的发生率发生实质性变化[45]。
由于在第一次分析中达到了主要终点,阿帕鲁胺于2019年获得了FDA和EMA的批准。在最终的OS分析中,经过52个月的中位随访,阿帕鲁胺组的中位OS显著长于安慰剂组(73.9个月VS59.9个月),达到了预先指定的统计显著性(HR=0.78;95%CI:0.64~0.96;P=0.016)[46]。
达鲁酰胺
FDA和EMA对nmCRPC患者研究和批准的最后一种AR拮抗剂是达洛他胺。达鲁酰胺是第三代AR拮抗剂,可抑制过表达AR细胞中的雄激素结合和雄激素诱导的易位。已经证明,即使在具有AR突变的细胞中,它也可以作为AR拮抗剂发挥作用,从而对抗雄激素治疗产生耐药性,包括在恩扎鲁胺和阿扑鲁胺耐药性中起作用的AR(F876L)。达鲁酰胺具有独特的结构,对血脑屏障的渗透性较低,对γ-氨基丁酸a型受体的结合亲和力较低。因此,它有可能产生更少和更温和的不良事件。在Ⅰ期和Ⅱ期试验中,达鲁酰胺在mCRPC患者中显示出显著的抗肿瘤活性和良好的副作用[47,48]。
鉴于这些结果,进行了一项随机、双盲、安慰剂对照的Ⅲ期试验。雄激素受体拮抗剂促进无转移生存(ARAMIS)试验旨在评估达洛他胺治疗男性nmCRPC和PSADT的疗效和安全性≤10个月,包括恶性区域淋巴结(N1疾病)患者。共有1509例患者以2:1的比例随机分配,在继续ADT的同时接受达洛他胺1200 mg/天(两片300 mg/天,两次给药)(64%的患者)或安慰剂(36%)。该研究包括局部治疗后的BCR患者以及从未接受过局部治疗的患者。此外,这是三项试验中唯一一项没有排除有癫痫病史或有癫痫倾向的患者的试验。分层基于PSA-DT(>6 VS.≤6个月)和使用保骨剂[49]。
基线特征平衡良好。大多数患者患有N0疾病(达洛他胺组为83%,安慰剂组为71%)。达洛他胺组的平均PSA-DT为4.4个月,安慰剂组为4.7个月。平均PSA水平分别为9 ng/ml和9.7 ng/ml[49]。
在计划的初步分析中,随访中位数为17.9个月,达洛他胺组的MFS中位数为40.4个月,安慰剂组为18.4个月中(HR=0.41;95%CI:0.34~0.5;P<0.001)。在对136例死亡的OS进行的第一次中期分析中,与安慰剂相比,达洛他胺呈现出OS增加的趋势,但未达到统计学意义(HR=0.71;95%CI:0.5~0.99;P=0.045)[49]。
其他次要终点,如疼痛进展时间(中位数40.3个月VS. 25.4个月;HR=0.65;95%CI:0.53~0.79;P<0.001)、首次细胞抑制化疗时间(HR=0.43;95%CI:0.31~0.60;P<0.01)、首次有症状的骨骼事件时间(HR=0.43;95%CI:0.22~0.84;P<0.001)、PFS(HR=0~0.38;95%CI:0.32~0.45)或PSA进展时间(HR=0.13;95%CI:0.11~0.16;P<0.001)显著长于安慰剂[49]。
关于安全性,达洛他胺组有83.2%的患者报告了任何级别的不良事件,而安慰剂组为76.9%。在达洛他胺组中,24.7%出现3~4级不良事件,而安慰剂组为19.5%。两组的5级不良事件具有可比性(分别为3.9%和3.2%)。两组之间因不良事件导致的治疗中断率无显著差异(分别为8.9%和8.7%)。与安慰剂相比,达洛他胺更常出现的不良事件包括高血压(6.6%VS5.2%)、心力衰竭(1.9%VS0.9%)、骨折(4.2%VS3.6%)和疲劳/乏力(15.8%VS11.4%)[50]。与中枢神经系统和冠状动脉系统相关的不良事件与两种治疗方法相似。达洛他胺维持了HRQOL,延缓了PCa相关症状的出现和HRQOL的恶化[50]。
在第一个中期分析结果发表后,该研究被解盲并允许交叉。因此,留在安慰剂组的170例患者接受了达鲁他胺治疗。中位随访29个月,达鲁他胺在OS方面显示了统计学上显著的好处,83%的患者3年生存期,而接受安慰剂的患者3年生存期为77%(HR=0.69;95%CI:0.53~0.88;P=0.003)[51]。
三种药物之间的比较(表3)
Full table
虽然这三项试验彻底改变了nmCRPC的治疗,但这三种药物之间没有直接的比较数据。因此,许多间接荟萃分析被设计用来帮助指导治疗决策。
Mori等人设计了上述3个阶段Ⅲ期试验(SPARTAN、PROSPER和ARAMIS)的荟萃分析,以间接比较三种药物的疗效和安全性。这项荟萃分析是基于不成熟的OS数据进行的。对于MFS,三种药物均显著优于安慰剂,阿帕鲁胺是最有效的药物(P=0.8809)。与达鲁他胺相比,阿帕鲁他胺(HR=0.85;95%CI:0.77~0.94)和恩扎鲁他胺的MFS显著改善。三种药物的3级或4级不良事件发生率均高于安慰剂。然而,达洛他胺和安慰剂具有相似的5级不良事件发生率和相似的不良事件停药率(OR1.20 VS. OR1.03)。相比之下,阿帕鲁胺(OR5.01 VS. OR1.56)和恩扎鲁胺(OR5.49 VS. OR1.61)出现5级不良事件的频率更高,毒性导致治疗中止。基于这一荟萃分析,阿帕鲁胺和恩扎鲁胺似乎是治疗nmCRPC最有效的药物。然而,达洛他胺是一种更具耐受性的药物。这些发现可能有助于指导个体化治疗策略,并为未来的直接比较试验提供信息[52]。
三项试验之间的另一项荟萃分析证实了这些结果。在这项荟萃分析中,阿帕鲁胺和恩扎鲁他胺的MFS显著高于达鲁他胺,HR分别为0.73(95%CI:0.55~0.97)和0.71(95%CI:0.54~0.93),OS无差异。尽管在不良事件方面没有显示出显著差异,但达洛他胺具有最高的耐受概率[53]。
使用SPARTAN和ARAMIS试验的个体患者水平数据进行的第三项荟萃分析已经发表。本研究进行了锚定匹配调整间接比较(MAIC),调整SPARTAN试验中包括的患者,以匹配PROSPER试验中包括患者的基线特征。然后,重新分析了新SPARTAN的MFS和OS。阿帕鲁胺与恩扎鲁胺基于MAIC的小时数,MFS为0.91(95%CI:0.68~1.22),OS为0.77(95%CI:0.46~1.30)。鉴于这些结果,阿帕鲁胺似乎比恩扎鲁胺更能改善MFS和OS[54]。
2019年发表的荟萃分析包括三项Ⅲ期随机试验(PROSPER、SPARTAN和ARAMIS)中期分析的汇总数据。该荟萃分析得出结论,这些药物改善MFS,差异具有统计学意义(HR=0.32;95%CI:0.25~0.41;P<0.001)。尽管如此,服用这些激素制剂与治疗相关死亡风险增加显著相关,相对风险(RR)为2.41(95%CI:1.37~4.24;P=0.002)。它们还增加了心血管事件(RR=2.44)、骨折(RR=2.24)、跌倒(RR=2)和高血压(RR=1.38)的风险。与安慰剂相比,三种药物不会增加疲劳、腹泻、皮疹或癫痫发作的风险。然而,恩扎鲁胺显示出较高的死亡风险、心血管毒性和疲劳,阿帕鲁胺显示跌倒、骨折和皮疹的风险增加,达鲁酰胺与心血管毒性风险增加相关[55]。
最后,对上述三项试验的汇总数据进行探索性分析,根据年龄,研究了3种药物在nmCRPC患者中的安全性和有效性。在这三项试验中,共有4,117例男性患者参与,2694例男性患者接受第二代AR抑制剂(阿帕鲁胺、恩扎鲁胺或达鲁胺),1,423例男性患者接受安慰剂。在这些试验中,共有1,023例男性患者年龄在80岁或以上,另外3,094例患者则更年轻。≥80岁分配到第二代AR抑制剂组的男性患者亚组的中值MFS为40个月,安慰剂组为22个月,调整后的HR为0.37(95%CI:0.28~0.47)。对于<80岁的患者,MFS中位数分别为41个月和16个月(HR=0.31;95%CI:0.27~0.35)。关于OS,≥80岁分配到第二代AR抑制剂组的男性患者的平均OS为54个月,安慰剂组为49个月。80岁以下男性患者的平均OS为74个月,而安慰剂组为61个月,校正HR为0.69(95%CI:0.60~0.80)。关于毒性,>80岁使用第二代AR抑制剂治疗的男性患者略为常见分级≥3 AEs不良事件在。另一方面,在接受第二代AR抑制剂治疗的80岁以下男性患者中,只有44%的人出现分级≥3 AEs,安慰剂组为30%。最常见的3~4级不良事件是高血压(两个年龄组中使用AR抑制剂的患者占8%,而80岁以下男性患者占5%,男性患者占6%)≥80岁(安慰剂组)和骨折(AR抑制剂组分别为3%和5%,安慰剂组分别为1%和3%)。这些结果支持在nmCRPC患者中使用这三种药物,无论年龄[56]。
虽然尚未对这三种药物进行直接比较,但这些荟萃分析可能有助于指导治疗决策,并为未来直接比较试验的设计奠定基础[52-55]。
未来方向
nmCRPC处于前列腺特异性膜抗原配体正电子发射断层扫描(PSMA−PET)时代
三种用于治疗nmCRPC的第二代AR抑制剂的批准使非转移性和转移性CRPC更紧密地结合在一起。尽管如此,使得这些药物获得批准的Ⅲ期临床试验包括根据标准成像(骨扫描和CT)无远处转移而被归类为非转移性的患者。我们现在知道,这些传统的成像方式没有足够的灵敏度来识别大部分患者是否存在转移。CT扫描诊断恶性淋巴结的敏感性为42%。同时,骨扫描对识别骨转移有79%的敏感性和82%的特异性。基于使用几种PET示踪剂的新成像技术正在研究中,一些已经在临床实践中建立。这些PET示踪剂包括18F氟西洛韦、68Ga PSMA和18F氟化钠(NaF)。一项针对30例nmCRPC患者的研究显示,在PSA水平高于2 ng/mL(20/20)的患者中,68GaPSMA PET/CT检测到100%的转移,而在PSA较低的患者中(7/10)检测到70%。一项荟萃分析将骨扫描与PSMA−PET/CT进行了比较,观察到PSMA−PET/CT具有更高的敏感性(骨扫描为0.97 VS. 0.86),具有可比的特异性(骨扫描0.95,PSMA−PET/CT为1.00)。68GaPSMA PET/CT还显示与ADT后PSA反应相关的原发肿瘤和转移淋巴结的最大标准化摄取值(SUVmax)显著降低。随着新型成像技术的广泛使用,诊断为nmCRPC的患者数量可能会减少[13,18,57-60]。
PSMA−PET在nmCRPC中的作用尚不清楚。由于PSMA−PET的较高敏感性,转移可能会更早地发现,这将导致疾病阶段的重新分类,从而可能影响疾病的管理。一项回顾性研究评估了PSMA−PET对盆腔和远处转移的敏感性。本研究包括200例高危nmCRPC患者(定义为PSA>2 ng/mL,PSA−DT)≤10个月或Gleason评分为8。该分析中包括的人群与上述第3阶段试验中描述的人群相似。使用PSMA−PET成像,共有98%的患者有局部复发或转移:24%仅有局部复发,55%有M1疾病。在29%的患者中,N1或M1疾病是少转移性的(1~3个病灶),多发性(≥4个病灶)占46%。这项回顾性试验表明,如果在筛查时采用分子成像技术,PROSPER、SPARTAN和ARAMIS试验中的大部分男性患者将被归类为mCRPC[13]。
nmCRPC的定义完全取决于放射学发现,并不根据肿瘤的生物学特性。随着分子成像技术的实施,预计将更少的男性归类为nmCRPC患者。此外,恩扎鲁胺、阿帕鲁胺和达鲁胺在所有高危nmCRPC患者(定义为PSA-DT≤10个月)中显示出重要的临床改善,而不考虑通过更敏感的成像技术检测到转移。鉴于PROSPER、SPARTAN和ARAMIS试验中MFS和OS的益处,尽早开始更密集的治疗方法可能是高风险nmCRPC男性患者的最佳策略,与新成像技术确定是否存在转移无关[57]。
分子亚型
nmCRPC患者的个体化管理可以改善其OS和生活质量。分子生物标记物可以帮助识别转移风险较高的患者。一项队列研究用来评估分子亚型是否可以预测对阿帕鲁胺的反应。在本研究中,分析了SPARTAN试验中包括的233例nmCRPC患者肿瘤的基因表达[61]。
根据基因组分类(GC)得分和基底型或腔型进行分层(高风险>0.6;低风险)≤0.6)。The Decipher prostate test是一种报告GC分数的基因表达分类器。该评分已被证实为局部PCa转移风险的预测因子。另一方面,管腔和基底分子分类确定了一种更惰性的疾病,具有高AR信号(管腔型PCa)和更具侵袭性的亚型(基底型PCa)[61]。
共有116例患者(分析患者的50%)具有高风险GC评分。虽然需要强调的是,所有患者都受益于向ADT中添加阿扑鲁胺,但根据GC评分,转移风险高的患者从ADT中受益最多,与安慰剂加ADT相比,MFS的HR为0.21(95%CI::0.11~0.4;P<0.001)。与这些结果一致,在GC评分>0.6的患者中,OS(HR=0.52;95%CI:0.29~0.94;P=0.03)和PFS2(HR=0.39;95%CI:0.23~0.67;P=0.001)也显示了在ADT中添加阿扑鲁胺后的显著改善。同时,在ADT中添加阿扑鲁胺后,低风险GC评分的患者具有临界益处(HR=0.46;95%CI:0.23~0.95;P=0.04)。然而,阿扑鲁胺的作用与MFS、OS或PFS2的GC评分之间没有统计学意义的交互作用[61]。
关于GC评分的预后价值,在分析接受ADT加安慰剂治疗的患者时,观察到高风险患者的MFS显著短于低风险患者的GC评分(MFS中位数14.5vs22.1个月;HR=0.43;95%CI:0.22~0.85;P=0.01)。相反,在分析接受阿帕鲁胺联合ADT的患者时,GC得分没有观察到差异(HR=1.11;95%CI:0.58~2.13;P=0.75)。在OS和PFS2中观察到了类似的趋势。鉴于这些结果,在ADT中添加阿帕鲁胺似乎可以克服在高危GC评分患者中观察到的更差预后[61]。
关于管腔和基底亚型,65%的患者被分类为基底分子亚型。在ADT中加入阿帕鲁胺后,两种亚型的MFS均显著增加,管腔亚型的HR为0.22(95%CI:0.08~0.56;P=0.002),基础亚型的HR为0.34(95%CI:0.20~0.58;P<0.001)。在接受ADT加安慰剂治疗的患者中,未观察到管腔亚型和基底亚型之间的差异。尽管如此,在阿帕鲁胺+ADT组中,管腔型肿瘤患者的MFS获益率高于基底型肿瘤患者HR为0.4(95%CI:0.18~0.91;P=0.03)。在OS和PFS2中观察到了类似的趋势。如前所述,所有患者似乎都受益于添加阿帕鲁胺。尽管如此,这些发现表明,患有腔型肿瘤的男性患者可能从这种治疗中受益最大[61]。
鉴于这些结果,GC评分和分子亚型(基础型或管腔型)可能是nmCRPC患者在ADT中添加阿帕鲁胺时反应的良好预测因子。所有患者都受益于阿帕鲁他胺治疗,但受益最多的患者是具有高风险GC评分和腔内亚型肿瘤的患者。GC评分可能有助于确定第二代激素治疗的最佳候选人,基底腔分型可能有助于选择基底亚型肿瘤患者,并结合第二代激素治疗进一步强化治疗[61]。
正在进行的临床试验
我们在表4中总结了正在进行的针对nmCRPC患者的试验。
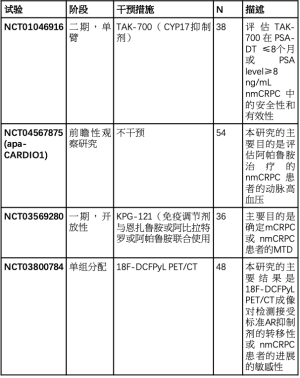
Full table
结论
nmCRPC是一种从惰性到快速进展的异质性疾病状态。如今,PSA−DT是选择高转移风险患者的最佳工具。多年来,已经研究了几种药理学策略,以在未选择性nmCRPC人群中延迟转移性疾病的出现。然而,直到2018年,他们都没有表现出对OS的提高。
最近,FDA和EMA批准了前3种治疗nmCRPC的药物。恩扎鲁他胺、阿帕鲁他胺和达鲁他胺在选定的高危人群(PSA−DT)中显示出MFS和OS的改善,具有合理的安全性≤10个月)。鉴于这些结果,每名nmCRPC和PSA−DT患者≤10个月应使用这些药物中的一种进行治疗,除非它们存在严重的共病,限制OS超过PCa。
虽然尚未对这三种药物进行直接比较,但三项具有间接比较的荟萃分析表明,阿帕鲁胺和恩扎鲁胺可能更有效,而达鲁他胺似乎具有最佳耐受性。
随着新型成像技术的出现,nmCRPC作为一种独特疾病,未来更值得探讨。然而,考虑到这些试验中MFS和OS的益处,使用第二代AR拮抗剂进行早期强化治疗可能是nmCRPC的最佳选择,无论是否通过分子成像技术检测转移。
最后,生物标志物将有助于nmCRPC患者的个体化治疗,并更好地识别那些可以从添加第二代AR拮抗剂中受益的患者。GC评分和基底管腔亚型可作为预测反应的生物标志物,尽管需要更多数据来证实其预测值。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the editorial office, Precision Cancer Medicine. The article has undergone external peer review.
Reporting Checklist: The authors have completed the Narrative Review reporting checklist. Available at https://pcm.amegroups.com/article/view/10.21037/pcm-21-34/rc
Peer Review File: Available at https://pcm.amegroups.com/article/view/10.21037/pcm-21-34/prf
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at https://pcm.amegroups.com/article/view/10.21037/pcm-21-34/coif). JP serves as an unpaid editorial board member of Precision Cancer Medicine from May 2021 to April 2023. NV reports that she has received honoraria for speakers’ bureaus from Janssen and Astellas. JGR has received honoraria from Astellas, Janssen, Bayer, and AstraZeneca, as well as consulting fees from Jannsen and Recordati. Reports honoraria from Pfizer, Bristol Myers Squibb, Ipsen, AstraZeneca, Roche, MSD Oncology, Janssen-Cilag, Astellas Pharma, EUSA Pharma, Eisai, Pierre Fabre, Sanofi, and Bayer; a consulting or advisory role from Pfizer, Astellas Pharma, Janssen-Cilag, Merck Sharp & Dohme, Bayer, Roche, Bristol Myers Squibb, Clovis Oncology, Ipsen, Eisai, and Sanofi; research funding from Astellas Pharma and Pfizer and travel/accommodations/expenses from Pfizer, Roche, Janssen-Cilag, Bristol Myers Squibb, and MSD Oncology. The other authors have no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Globocan 2020. Available online: https://gco.iarc.fr/today/online-analysis-table?v=2020&mode=cancer&mode_population=continents&population=900&populations=900&key=asr&sex=1&cancer=39&type=1&statistic=5&prevalence=0&population_group=0&ages_group%5B%5D=0&ages_group%5B%5D=17&group_cancer=1&include_nmsc=1&include_nmsc_other=1
- National Comprehensive Cancer Network. Prostate cancer early detection (Version 2.2021). Available online: https://www.nccn.org/professionals/physician_gls/pdf/prostate_detection.pdf. Access November 9, 2021.
- Larrañaga N, Galceran J, Ardanaz E, et al. Prostate cancer incidence trends in Spain before and during the prostate-specific antigen era: impact on mortality. Ann Oncol 2010;21:iii83-89. [Crossref] [PubMed]
- De Angelis R, Sant M, Coleman MP, et al. Cancer survival in Europe 1999-2007 by country and age: results of EUROCARE--5-a population-based study. Lancet Oncol 2014;15:23-34. [Crossref] [PubMed]
- Freedland SJ, Humphreys EB, Mangold LA, et al. Risk of prostate cancer-specific mortality following biochemical recurrence after radical prostatectomy. JAMA 2005;294:433-9. [Crossref] [PubMed]
- Kupelian PA, Mahadevan A, Reddy CA, et al. Use of different definitions of biochemical failure after external beam radiotherapy changes conclusions about relative treatment efficacy for localized prostate cancer. Urology 2006;68:593-8. [Crossref] [PubMed]
- Sayegh N, Agarwal N, Swami U. Drug Development for Prostate Cancer with Biochemical Recurrence: Trials and Tribulations. Eur Urol Oncol 2021;4:553-7. [Crossref] [PubMed]
- Gong J, Payne D, Caron J, et al. Reduced Cardiorespiratory Fitness and Increased Cardiovascular Mortality After Prolonged Androgen Deprivation Therapy for Prostate Cancer. JACC CardioOncol 2020;2:553-63. [Crossref] [PubMed]
- Marshall CH, Chen Y, Kuo C, et al. Timing of Androgen Deprivation Treatment for Men with Biochemical Recurrent Prostate Cancer in the Context of Novel Therapies. J Urol 2021;206:623-9. [Crossref] [PubMed]
- Morris MJ, Mota JM, Lacuna K, et al. Phase 3 Randomized Controlled Trial of Androgen Deprivation Therapy with or Without Docetaxel in High-risk Biochemically Recurrent Prostate Cancer After Surgery (TAX3503). Eur Urol Oncol 2021;4:543-52. [Crossref] [PubMed]
- Nussbaum N, George DJ, Abernethy AP, et al. Patient experience in the treatment of metastatic castration-resistant prostate cancer: state of the science. Prostate Cancer Prostatic Dis 2016;19:111-21. [Crossref] [PubMed]
- Cornford P, Bellmunt J, Bolla M, et al. EAU-ESTRO-SIOG Guidelines on Prostate Cancer. Part II: Treatment of Relapsing, Metastatic, and Castration-Resistant Prostate Cancer. Eur Urol 2017;71:630-42. [Crossref] [PubMed]
- Fendler WP, Weber M, Iravani A, et al. Prostate-Specific Membrane Antigen Ligand Positron Emission Tomography in Men with Nonmetastatic Castration-Resistant Prostate Cancer. Clin Cancer Res 2019;25:7448-54. [Crossref] [PubMed]
- Heidegger I, Brandt MP, Heck MM. Treatment of non-metastatic castration resistant prostate cancer in 2020: What is the best? Urol Oncol 2020;38:129-36. [Crossref] [PubMed]
- Crawford ED, Stone NN, Yu EY, et al. Challenges and recommendations for early identification of metastatic disease in prostate cancer. Urology 2014;83:664-9. [Crossref] [PubMed]
- Smith MR, Kabbinavar F, Saad F, et al. Natural history of rising serum prostate-specific antigen in men with castrate nonmetastatic prostate cancer. J Clin Oncol 2005;23:2918-25. [Crossref] [PubMed]
- Smith MR, Saad F, Oudard S, et al. Denosumab and bone metastasis-free survival in men with nonmetastatic castration-resistant prostate cancer: exploratory analyses by baseline prostate-specific antigen doubling time. J Clin Oncol 2013;31:3800-6. [Crossref] [PubMed]
- Anantharaman A, Small EJ. Tackling non-metastatic castration-resistant prostate cancer: special considerations in treatment. Expert Rev Anticancer Ther 2017;17:625-33. [Crossref] [PubMed]
- Gupta R, Sheng IY, Barata PC, et al. Non-metastatic castration-resistant prostate cancer: current status and future directions. Expert Rev Anticancer Ther 2020;20:513-22. [Crossref] [PubMed]
- Tombal B. Non-metastatic CRPC and asymptomatic metastatic CRPC: which treatment for which patient? Ann Oncol 2012;23:x251-8. [Crossref] [PubMed]
- Mason MD, Sydes MR, Glaholm J, et al. Oral sodium clodronate for nonmetastatic prostate cancer--results of a randomized double-blind placebo-controlled trial: Medical Research Council PR04 (ISRCTN61384873). J Natl Cancer Inst 2007;99:765-76. [Crossref] [PubMed]
- Nelson JB, Love W, Chin JL, et al. Phase 3, randomized, controlled trial of atrasentan in patients with nonmetastatic, hormone-refractory prostate cancer. Cancer 2008;113:2478-87. [Crossref] [PubMed]
- Miller K, Moul JW, Gleave M, et al. Phase III, randomized, placebo-controlled study of once-daily oral zibotentan (ZD4054) in patients with non-metastatic castration-resistant prostate cancer. Prostate Cancer Prostatic Dis 2013;16:187-92. [Crossref] [PubMed]
- Smith MR, Saad F, Coleman R, et al. Denosumab and bone-metastasis-free survival in men with castration-resistant prostate cancer: results of a phase 3, randomised, placebo-controlled trial. Lancet 2012;379:39-46. [Crossref] [PubMed]
- Madan RA, Gulley JL, Schlom J, et al. Analysis of overall survival in patients with nonmetastatic castration-resistant prostate cancer treated with vaccine, nilutamide, and combination therapy. Clin Cancer Res 2008;14:4526-31. [Crossref] [PubMed]
- Beinart G, Rini BI, Weinberg V, et al. Antigen-presenting cells 8015 (Provenge) in patients with androgen-dependent, biochemically relapsed prostate cancer. Clin Prostate Cancer 2005;4:55-60. [Crossref] [PubMed]
- Tran C, Ouk S, Clegg NJ, et al. Development of a second-generation antiandrogen for treatment of advanced prostate cancer. Science 2009;324:787-90. [Crossref] [PubMed]
- Prekovic S, van Royen ME, Voet AR, et al. The Effect of F877L and T878A Mutations on Androgen Receptor Response to Enzalutamide. Mol Cancer Ther 2016;15:1702-12. [Crossref] [PubMed]
- Xie W, Regan MM, Buyse M, et al. Metastasis-Free Survival Is a Strong Surrogate of Overall Survival in Localized Prostate Cancer. J Clin Oncol 2017;35:3097-104. [Crossref] [PubMed]
- Mori A, Hashimoto K, Koroki Y, et al. The correlation between metastasis-free survival and overall survival in non-metastatic castration resistant prostate cancer patients from the Medical Data Vision claims database in Japan. Curr Med Res Opin 2019;35:1745-50. [Crossref] [PubMed]
- Beaver JA, Kluetz PG, Pazdur R. Metastasis-free Survival - A New End Point in Prostate Cancer Trials. N Engl J Med 2018;378:2458-60. [Crossref] [PubMed]
- Beer TM, Armstrong AJ, Rathkopf DE, et al. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 2014;371:424-33. [Crossref] [PubMed]
- Scher HI, Fizazi K, Saad F, et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med 2012;367:1187-97. [Crossref] [PubMed]
- Penson DF, Armstrong AJ, Concepcion R, et al. Enzalutamide Versus Bicalutamide in Castration-Resistant Prostate Cancer: The STRIVE Trial. J Clin Oncol 2016;34:2098-106. [Crossref] [PubMed]
- Alpajaro SIR, Harris JAK, Evans CP. Non-metastatic castration resistant prostate cancer: a review of current and emerging medical therapies. Prostate Cancer Prostatic Dis 2019;22:16-23. [Crossref] [PubMed]
- Hussain M, Fizazi K, Saad F, et al. Enzalutamide in Men with Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med 2018;378:2465-74. [Crossref] [PubMed]
- Attard G, Saad F, Tombal BF, et al. Health-related quality of life (HRQoL) deterioration and pain progression in men with non-metastatic castration-resistant prostate cancer (M0 CRPC): Results from the PROSPER study. J Clin Oncol 2018;36:abstr 5010.
- Sternberg CN, Fizazi K, Saad F, et al. Enzalutamide and Survival in Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med 2020;382:2197-206. [Crossref] [PubMed]
- De Giorgi U, Hussain MHA, Shore ND, et al. PROSPER subgroup analysis by age and region: Overall survival and safety in men with nonmetastatic castration-resistant prostate cancer receiving androgen deprivation therapy plus enzalutamide. J Clin Oncol 2021;39:abstr 84.
- Smith MR, Antonarakis ES, Ryan CJ, et al. Phase 2 Study of the Safety and Antitumor Activity of Apalutamide (ARN-509), a Potent Androgen Receptor Antagonist, in the High-risk Nonmetastatic Castration-resistant Prostate Cancer Cohort. Eur Urol 2016;70:963-70. [Crossref] [PubMed]
- Smith MR, Saad F, Chowdhury S, et al. Apalutamide Treatment and Metastasis-free Survival in Prostate Cancer. N Engl J Med 2018;378:1408-18. [Crossref] [PubMed]
- Graff JN, Smith MR, Saad F, et al. Age-related efficacy and safety of apalutamide (APA) plus ongoing androgen deprivation therapy (ADT) in subgroups of patients (pts) with nonmetastatic castration-resistant prostate cancer (nmCRPC): Post hoc analysis of SPARTAN. J Clin Oncol 2019;37:abstr 5024.
- Small EJ, Saad F, Chowdhury S, et al. Apalutamide and overall survival in non-metastatic castration-resistant prostate cancer. Ann Oncol 2019;30:1813-20. [Crossref] [PubMed]
- Saad F, Cella D, Basch E, et al. Effect of apalutamide on health-related quality of life in patients with non-metastatic castration-resistant prostate cancer: an analysis of the SPARTAN randomised, placebo-controlled, phase 3 trial. Lancet Oncol 2018;19:1404-16. [Crossref] [PubMed]
- Small EJ, Saad F, Chowdhury S, et al. Updated analysis of progression-free survival with first subsequent therapy (PFS2) and safety in the SPARTAN study of apalutamide (APA) in patients (pts) with high-risk nonmetastatic castration-resistant prostate cancer (nmCRPC). J Clin Oncol 2019;37:abstr 144.
- Smith MR, Saad F, Chowdhury S, et al. Apalutamide and Overall Survival in Prostate Cancer. Eur Urol 2021;79:150-8. [Crossref] [PubMed]
- Moilanen AM, Riikonen R, Oksala R, et al. Discovery of ODM-201, a new-generation androgen receptor inhibitor targeting resistance mechanisms to androgen signaling-directed prostate cancer therapies. Sci Rep 2015;5:12007. [Crossref] [PubMed]
- Shore ND, Tammela TL, Massard C, et al. Safety and Antitumour Activity of ODM-201 (BAY-1841788) in Chemotherapy-naïve and CYP17 Inhibitor-naïve Patients: Follow-up from the ARADES and ARAFOR Trials. Eur Urol Focus 2018;4:547-53. [Crossref] [PubMed]
- Fizazi K, Shore N, Tammela TL, et al. Darolutamide in Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med 2019;380:1235-46. [Crossref] [PubMed]
- Smith MR, Shore N, Tammela TL, et al. Darolutamide and health-related quality of life in patients with non-metastatic castration-resistant prostate cancer: An analysis of the phase III ARAMIS trial. Eur J Cancer 2021;154:138-46. [Crossref] [PubMed]
- Fizazi K, Shore N, Tammela TL, et al. Nonmetastatic, Castration-Resistant Prostate Cancer and Survival with Darolutamide. N Engl J Med 2020;383:1040-9. [Crossref] [PubMed]
- Mori K, Mostafaei H, Pradere B, et al. Apalutamide, enzalutamide, and darolutamide for non-metastatic castration-resistant prostate cancer: a systematic review and network meta-analysis. Int J Clin Oncol 2020;25:1892-900. [Crossref] [PubMed]
- Kumar J, Jazayeri SB, Gautam S, et al. Comparative efficacy of apalutamide darolutamide and enzalutamide for treatment of non-metastatic castrate-resistant prostate cancer: A systematic review and network meta-analysis. Urol Oncol 2020;38:826-34. [Crossref] [PubMed]
- Chowdhury S, Oudard S, Uemura H, et al. Matching-Adjusted Indirect Comparison of the Efficacy of Apalutamide and Enzalutamide with ADT in the Treatment of Non-Metastatic Castration-Resistant Prostate Cancer. Adv Ther 2020;37:501-11. [Crossref] [PubMed]
- Di Nunno V, Mollica V, Santoni M, et al. New Hormonal Agents in Patients With Nonmetastatic Castration-Resistant Prostate Cancer: Meta-Analysis of Efficacy and Safety Outcomes. Clin Genitourin Cancer 2019;17:e871-7. [Crossref] [PubMed]
- Fallah J, Zhang L, Amatya A, et al. Survival outcomes in older men with non-metastatic castration-resistant prostate cancer treated with androgen receptor inhibitors: a US Food and Drug Administration pooled analysis of patient-level data from three randomised trials. Lancet Oncol 2021;22:1230-9. [Crossref] [PubMed]
- Esther J, Dorff TB, Maughan BL. Recent developments in the treatment of non-metastatic castration resistant prostate cancer. Cancer Treat Res Commun 2020;24:100181. [Crossref] [PubMed]
- Fourquet A, Aveline C, Cussenot O, et al. 68Ga-PSMA-11 PET/CT in restaging castration-resistant nonmetastatic prostate cancer: detection rate, impact on patients' disease management and adequacy of impact. Sci Rep 2020;10:2104. [Crossref] [PubMed]
- Zhou J, Gou Z, Wu R, et al. Comparison of PSMA-PET/CT, choline-PET/CT, NaF-PET/CT, MRI, and bone scintigraphy in the diagnosis of bone metastases in patients with prostate cancer: a systematic review and meta-analysis. Skeletal Radiol 2019;48:1915-24. [Crossref] [PubMed]
- Onal C, Guler OC, Torun N, et al. The effect of androgen deprivation therapy on 68Ga-PSMA tracer uptake in non-metastatic prostate cancer patients. Eur J Nucl Med Mol Imaging 2020;47:632-41. [Crossref] [PubMed]
- Feng FY, Thomas S, Saad F, et al. Association of Molecular Subtypes With Differential Outcome to Apalutamide Treatment in Nonmetastatic Castration-Resistant Prostate Cancer. JAMA Oncol 2021;7:1005-14. [Crossref] [PubMed]
(English Language Editor: Dianne Fitzgerald)
彭林佳
复旦大学附属肿瘤医院(更新时间:2023-05-05)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Vidal N, Gómez Rivas J, Fernández L, Moreno J, Puente J. The past, present, and future of non-metastatic castration-resistant prostate cancer (nmCRPC): a narrative review. Precis Cancer Med 2022;5:14.

