
女性癌基因成瘾性非小细胞肺癌:关于治疗结果中性别相关差异重要性的叙述性回顾
介绍
在西方国家,肺癌是癌症相关死亡的主要原因。非小细胞肺癌(NSCLC)占原发性肺癌的85%以上,并且大约三分之二的NSCLC患者被诊断为晚期,且预后很差[1]。表皮生长因子受体(EGFR)突变和间变性淋巴瘤激酶(ALK)重排等驱动癌基因改变的发现及其靶向抑制剂的问世,显著改善了高度选择性患者的预后[2,3]。性别差异不仅会影响肿瘤的预后,还会影响全身抗癌治疗的疗效、活性和不良反应。事实上,一些研究表明,两性在药物代谢酶[4]、性激素水平[5]和免疫系统功能[6]的遗传多态性方面存在重要差异。据报道,与性别相关的吸烟易感性也存在差异(女性患肺癌的风险似乎更高)[7],再加上与男性相比,女性开始吸烟的时间较晚,这两方面可能部分解释了近几十年来女性肺癌发病率增加这一流行病学变化。在NSCLC中,无论分期、治疗方式或组织学,性别都具有确定的独立预后价值,男性的死亡风险是女性的1.6倍[8]。这一证据应对临床试验的设计和解读产生影响,因为女性在临床试验中的代表性越来越强。然而,很少有数据表明男性和女性患有致癌基因成瘾性非小细胞肺癌(NSCLC)并接受靶向药物治疗的潜在结果差异。本文总结了目前关于这一主题的证据。
本文根据Narrative Review reporting checklist评估、呈现文章 (详见 https://pcm.amegroups.com/article/view/10.21037/pcm-21-31/rc)
方法
关于癌基因成瘾的非小细胞肺癌的治疗信息已有20多年的历史。本研究仅限于使用扩展文献数据收集的英文发表的文献,并侧重于Ⅲ期试验(表1)。

Full table
EGFR酪氨酸激酶抑制剂(TKI)
比较一线化疗联合或不联合吉非替尼或厄洛替尼的4项关键随机试验显示,在晚期NSCLC患者的标准铂类化疗中加入TKIs没有益处[9-12]。需要强调的是,纳入的患者人群是未经选择的。然而,在事后分析中,出现了一些与TKI联合化疗获益相关的临床特征:腺癌、女性、非吸烟状态和种族。同时,在NSCLC患者中,临床研究发现了人类表皮受体(HER)受体家族成员的突变,更准确地说,是EGFR突变的存在。激活EGFR突变的患者是那些在化疗中加入TKI获益最多的患者[13]。从上述回顾性研究中确定的患者临床亚组中发现EGFR突变频率较高:不吸烟者/吸烟者(51% VS. 10%),腺癌与其他组织学(40% VS. 3%),东亚/其他种族(30% VS. 8%),女性/男性(42% VS. 14%)在多变量分析中,所有这些因素都是TKIs获益的独立预测因素[14]。性别作为临床富集的一个因素出现,与EGFR突变的存在相关,因此,受益于TKIs的使用。一些报告还表明,常见突变亚型存在性别差异:外显子19的缺失更常与男性相关,而外显子21的点突变则与女性相关[15]。每种突变亚型发生的确切机制仍有待阐明;然而,一些作者推测,涉及DNA双链断裂和修复的染色体重组很可能与外显子19缺失有关。众所周知,减数分裂重组率显示出明显的性别差异[16]。
到目前为止,我们有三代不同的TKIs可用于临床实践:在EGFR突变的NSCLC患者中,所有患者在前期和后续治疗中都表现出比化疗更好的疗效。
大多数比较EGFR−TKIs与化疗的初始Ⅲ期试验也按性别描述了结果。然而,在随机化过程中,性别并不总是分层因素。
IPASS是首个比较吉非替尼与化疗(卡铂+紫杉醇)的研究,研究对象是根据吸烟习惯和组织学选择的亚洲临床富集患者人群。然而,参加这项研究的女性有965人,男性只有252人。因此,性别虽然没有声明,但也是临床选择的一个重要因素。在意向治疗分析中,TKI的无进展生存期(PFS)在统计学上并不劣于化疗:PFS或死亡的风险比(HR)为0.74;95%CI:0.65~0.85;P<0.01)。然而,在一次有计划的探索性分析中EGFR突变患者的PFS显著延长[17]。
另一边,东北日本研究小组(North−East Japan Study Group)[18]在未曾接受治疗的存在EGFR突变的患者中比较吉非替尼与化疗,并将性别作为分层因素。吉非替尼和化疗的中位PFS分别为10.8个月和5.4个月(HR 0.30;95%CI:0.22~0.41;P<0.001),TKI的有效率为73.7%,卡铂+紫杉醇组合的有效率为30.7%(P<0.001)。基于随机化前分层因素的分析显示,女性的PFS显著长于男性(HR 0.68;95%CI:0.51~0.92;P=0.01)(表2)。总体生存率在两组之间没有显著差异,性别不影响总生存率。然而,在当前的试验中,95%化疗失败的患者接受了二线吉非替尼治疗。
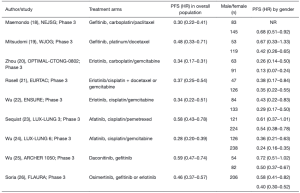
Full table
同年,西日本肿瘤组(West Japan Oncology Group,WJOG)[19]在EGFR突变的日本患者中进行了一项随机试验,在一线环境中比较了吉非替尼和顺铂/多西他赛。该研究对117例患者进行了随机分组,并像之前的研究一样提供了按性别进行的随机分组前分层。总体而言,吉非替尼中位PFS时间为9.2个月(95%CI:8.0~13.9)vs化疗组6.3个月(95%CI:5.8~7.8)(HR 0.49,95%CI:0.33~0.71,log-rank P<0.0001)。尽管接受吉非替尼治疗的女性的PFS比男性更长[女性PFS的HR为0.42(95%CI:0.26~0.65),男性PFS的HR为0.67(95%CI:0.33~1.33)],但性别与PFS没有统计学上的显著关系,单变量(HR 0.93;95%CI:0.62~1.39;P=0.742)与多变量分析也是如此(HR 0.63;95%CI:0.36~1.09;P=0.099)。
第一代TKI抑制剂厄洛替尼,在两项关键的Ⅲ期随机试验中进行了相同的研究。
Optimal−CTONG−0802[20]在中国的22个中心进行,并招募了154例随机接受口服厄洛替尼或卡铂/吉西他滨治疗的NSCLC患者。本研究不包括任何性别分层。实验组患者的中位PFS[13.1个月(95%CI:10.58~16.53)]与标准组的4.6个月(95%CI:4.21~5.42)]相比显著延长(HR 0.16;95%CI:0.10~0.26;P<0.0001)。PFS的益处似乎在所有临床亚组中都是一致的,包括性别;在这方面,女性的HR为0.13,男性的HR为0.2,有显著的统计学差异(表2)。然而,我们必须注意该研究没有足够的功效确定亚组中的显著差异。
在EURTAC试验[21]中,白种人患者随机接受厄洛替尼或标准化疗(顺铂联合多西他赛或顺铂/吉西他滨)。中位PFS厄洛替尼组为9.7个月(95%CI:8.4~12.3),化疗组为5.2个月(95%CI:4.5~5.8)(HR 0.37;95%CI:0.25~0.54;P<0.0001)。在多变量分析中,性别与年龄无显著相关性。PFS:HR女性为0.35,男性为0.38。EURTAC是第一个仅在非亚洲EGFR突变的NSCLC患者中进行的前瞻性Ⅲ期直接比较研究。西班牙肺癌组织(Spanish Lung Cancer Group)[27]对人群进行了筛查以确定该国的EGFR突变频率这项工作产生了有趣的结果——它显示,在欧洲患者人群中,EGFR激活突变的频率为16.6%(远低于亚洲种族),并证实EGFR突变在女性(69.7%)中比在男性(30.3%)中更常见。EGFR突变的NSCLC患者在第一次或以后的治疗中接受厄洛替尼作为标准治疗。有趣的是,临床结果因性别而有显著差异:男性PFS和OS持续时间的校正HR分别为2.94(95%CI:1.72~5.03)和3.48(95%CI:1.76~6.91)(P<0.001)。这意味着男性从EGFR突变肺癌进展的可能性是女性的3倍,死亡的可能性是女性的3.5倍。在EGFR重排类型之间也观察到PFS和OS的差异:考虑外显子19缺失与L858R点突变,PFS HR为1.92(95%CI:1.19~3.10)(P=0.02)和OS HR为2.98(95%CI:1.48~6.04)(P=0.002)。总的来说,患者接受厄洛替尼治疗的外显子19缺失患者的情况好于接受相同药物治疗的外显子21点突变患者。随后的数据证实了这一观察结果,有力地支持了由外显子19缺失引起的肺腺癌不同于由外显子21点突变引起的肺腺癌,并且具有不同的预后这一假设。此外,Rosell等人的论文结果显示,在携带L858R突变的患者组中,男性的PFS为6个月(95%CI:3.2~8.8),女性为16个月(95%CI:10.3~21.7)(P=0.004);特别是,在本研究中,从厄洛替尼获得的L858R突变腺癌男性的益处似乎与化疗相同。这些非常有趣的数据需要前瞻性证实,在这种情况下,我们不仅可以根据EGFR突变的类型来选择治疗方法,而且对于相同的突变,还可以根据性别来选择治疗方法。
2015年发表的一项荟萃分析,包括7项随机试验,将EGFR TKIs与一线化疗旨在评估不同EGFR突变和临床特征对PFS的影响。尽管荟萃分析显示EGFR突变类型与性别之间缺乏相关性(P=0.81),但与化疗相比,EGFR TKI治疗在PFS方面为女性提供的益处比男性高27%(P=0.02),并且性别的预测效果独立于吸烟状况和EGFR突变类型[28]。
Ⅲ期ENSURE研究评估了一线厄洛替尼与吉西他滨/顺铂治疗来自中国、马来西亚和菲律宾的晚期EGFR突变NSCLC患者的疗效。研究的主要终点是PFS并按性别对患者进行分层。总体而言,厄洛替尼的中位PFS为11.0个月,化疗的中位PFS为5.5个月(HR 0.34,95%CI:0.22~0.51;P<0.0001),而厄洛替尼的有效率为62.7%,化疗的有效率为33.6%。考虑到性别分层因素,女性PFS的HR为0.29(95%CI:0.17~0.50),男性为0.43(95%CI:0.22~0.83)。尽管厄洛替尼显著降低了男性患者和女性患者肺癌进展的风险,但女性患者的风险降低程度同样高于男性[22]。
Lux-Lung 3[23]随机Ⅲ期试验比较了一线阿法替尼与顺铂/培美曲塞联合用药。主要终点为PFS,第二代的EGFR TKI中位PFS为11.1个月对比于化疗的6.9个月(HR 0.58;95%CI:0.43~0.78;p=0.001)。亚组分析显示,PFS的益处在包括性别在内的所有临床相关特征中持续存在:女性和男性的HR分别为0.54和0.61(无统计学意义,但结果再次不同)。Lux-Lung 6[24]在阿法替尼与吉西他滨/顺铂治疗364例晚期EGFR来自中国、泰国和韩国的突变NSCLC患者的研究中报告了类似的结果。阿法替尼组的中位PFS显著延长(11.0个月;95%CI:9.7~13.7)于化疗组(5.6个月;95%CI:5.1~6.7)(HR 0.28;95%CI:0.20~0.39;P<0.0001)。PFS HR女性为0.24,男性为0.36。
Ⅲ期Archer 1050[25]试验是比较第一代(吉非替尼)和第二代EGFR TKIs(达科米替尼)的第二个试验。尽管这项研究是后来设计和实施的,但当出现性别导向活性的EGFR TKIs这一有趣数据时,它并没有预见到性别作为临床分层因素。然而,人口统计学特征基线略有不同,因为女性在实验组中占64%,而在对照组中占56%。达科米替尼组的中位PFS为14.7个月(95%CI:11.1~16.6),吉非替尼为9.2个月(95%CI:9.1~16.6)(HR 0.59;95%CI:0.47~0.74;P<0.0001)。根据预先指定的基线特征进行的PFS亚组分析证实,达科米替尼可显著改善PFS,女性HR为0.50,男性HR为0.72。这种差异在统计学上并不显著,但与所有先前暴露的研究一致,女性比男性更能降低疾病复发的风险。
FLAURA研究[26]比较了奥西替尼与吉非替尼或厄洛替尼治疗未经治疗的EGFR突变的NSCLC.该研究的主要终点是PFS,同样,该研究没有根据性别进行分层。结果令人印象深刻:奥西替尼与第一代TKIs相比中位PFS显著延长(18.9个月 vs. 10.2个月)(HR 0.46;95%CI:0.37~0.57;P<0.001)。两组的客观缓解率相似:奥西替尼组为80%,标准ITKS组为76%,但中位缓解持续时间分别为17.2个月和8.5个月。与标准TKIs相比,奥西替尼对男性和女性均有利,男性的PFS HR为0.58,女性为0.40。
此外,奥西替尼是第一个表现出优于对照组的生存优势的TKI。事实上,FLAURA研究[29]的总体生存分析显示,奥西替尼组的中位总生存期为38.6个月,对照组为31.8个月。男性和女性的生存优势相似:男性HR 0.79(95%CI:0.55~1.14),女性HR 0.79(95%CI:0.60~1.04)。
BR.21[30]试验比较了厄洛替尼与安慰剂在重度预治疗的未选择的晚期非小细胞肺癌患者中的疗效。该研究达到了OS的主要终点,厄洛替尼组为6.7个月,安慰剂组为4.7个月。性别间OS无显著差异,但女性应答率为14.4%,男性为6%(P=0.006),强调了性别作为临床富集因素的重要性。对于1,446例随机接受吉非替尼或多西他赛的预处理分子非选择性NSCLC患者的研究[31],可以进行同样的考虑。该研究达到了两种治疗之间OS的非劣效性的主要终点,但同样,在按性别进行的亚组分析中,吉非替尼的生存率女性患者高于男性患者(中位数分别为11.2个月和6.1个月),而多西他赛没有出现差异。
为了提高EGFR−TKIs的疗效,一种双重阻断策略(EGFR和VEGF途径)在未经治疗的EGFR突变患者中尝试。该试验将449例患者随机分为两组,一组接受厄洛替尼治疗,另一组接受厄洛替尼联合雷莫西单抗治疗。随机分组按性别分层。联合组的中位PFS为19.4个月(95%CI:15.4~21.6),厄洛替尼为12.4个月(95%CI:11.0~13.5),HR为0.50(95%CI:0.46~0.76;P<0.001)。在两种性别中均观察到联合用药的益处,但HR不同:男性为0.51(95%CI:0.34~0.75),女性为0.73(95%CI:0.54~0.99)[32]。NEJ026试验[33]通过使用类似的方法,比较了厄洛替尼联合贝伐单抗与单独使用厄洛替尼,并进一步强调了这一发现。此外,在这项研究中,随机分组按性别分层。实验组患者的中位PFS为16.9个月(95%CI:14.2~21.60月),厄洛替尼组为13.3个月(95%CI:11.1~15.3),HR为0.60(95%CI:0.41~0.87;P=0.016)。在亚组分析中,女性似乎是从HR为0.45的组合中获益最多的人(95%CI:0.28~0.73),男性为1.06(95%CI:0.58~1.94)。遗憾的是,没有进行后续的前瞻性研究来证实这一可能导致基于性别的差别待遇的发现。
总之,所有研究均显示,无论性别如何,EGFR−TKIs的PFS均优于首次或后续化疗。同样,这两项研究在比较第二代/第三代EGFR−ITKs与第一代中,揭示了新一代EGFR−ITKs在无进展生存期(PFS)中表现出优势,且与性别无关。值得注意的是,在上述报告的所有研究中,除一项研究外,女性的PFS风险降低幅度大于男性——EURTAC是唯一报告性别间PFS相似HR的研究。
在两个Ⅲ期试验中,抗血管生成抗体(雷莫西单抗或贝伐单抗)与EGFR TKI相关,并与单独的EGFR TKI进行比较。尽管两项研究均显示联合组获益更大,但按性别划分的PFS的HR结果相互矛盾。
ALK TKIs
EML4−ALK重排在约5%的NSCLC患者中发生,在从不/轻度吸烟者、腺癌亚型和年轻患者中更为常见。男性和女性NSCLC患者的ALK基因重排率分别为0~30.65%和2.63%~37.04%。一些作者指出,携带ALK重排的比值比在男性患者中减少了28%,尤其是在亚洲患者中[34],而在欧洲人群中却得到了相反的结果[35]。
克唑替尼是第一个在前期使用时表现出优于标准化疗的药物。在关键的Ⅲ期Profile 1014研究中,343例晚期ALK阳性NSCLC患者随机接受克唑替尼或联合化疗[36]。该研究的主要终点是PFS,并且该研究未根据性别进行分层。克唑替尼的中位PFS较长于化疗组[10.9个月 vs. 7.0个月(进展或死亡HR:0.45;95%CI:0.35~0.60;P<0.001)],并且在两性中都观察到了益处;然而,PFS的风险比在性别之间存在差异,分别为男性0.54(95%CI:0.36~0.82)和女性0.45(95%CI:0.32~0.63)(表3)。此外,在比较克唑替尼与化疗的两项随机Ⅲ期试验(Profile 1014和Profile 1007)中,纳入了更多的女性患者,根据性别亚组分析,该药物的疗效有差异的趋势[36,42]。

Full table
在未经治疗的ALK阳性患者中,将第二代ALK抑制剂赛瑞替尼与化疗进行比较。在Ⅲ期Ascend 4研究[37]中,376例患者随机接受赛瑞替尼750 mg/天或以铂为基础的化疗。中位PFS赛瑞替尼组为16.6个月,化疗组为8.1个月(进展或死亡HR:0.55;95%CI:0.42~0.73;P<0.0001);未报告OS差异。虽然这项研究没有根据性别分层,与化疗相比,赛瑞替尼的PFS在男性中的HR为0.41(95%CI:0.27~0.63)和女性HR为0.63(95%CI:0.43~0.93)(表3)。遗憾的是,没有按性别给出OS数据。
两项Ⅲ期试验比较了阿列替尼和克唑替尼:J-Alex研究仅在日本人群中进行[38],Alex试验在不同种族中进行[39]。在这两项试验中,阿列替尼在PFS方面的活性和疗效均显著优于克唑替尼。尽管两项研究均未按性别分层,但在Alex试验中,女性PFS的HR为0.39(95%CI:0.25~0.60),而男性PFS的HR为0.61(95%CI:0.38~0.98)。相反,在J-Alex研究中,PFS的HR在两种性别中相似:女性为0.31(95%CI:0.17~0.57);男性为0.35(95%CI:0.17~0.57)。
Alex试验更新的分析表明,阿列替尼的总体生存优势优于克唑替尼,HR为0.67(95%CI:0.46~0.98)。有趣的是,女性为0.76(95%CI:0.45~1.28),男性为0.66(95%CI:0.39~1.11;P=0.69)[43]。Alex试验的最初结果与更新分析的结果之间的差异尚不清楚。然而,不同性别的OS HR差异并不显著。
在ALTA-1L Ⅲ期试验中,与克唑替尼相比,布加替尼是第二代ALK抑制剂。布加替尼的中位PFS(研究的主要终点)未达到,为9.9个月(95%CI:9.0~12.9),进展或死亡的HR为0.49(95%CI:0.33~0.74;P<0.001),未有性别差异[40,44]。
Crown随机试验比较了氯拉替尼和克唑替尼在一线治疗中的作用[41]。氯拉替尼治疗12个月时无疾病进展的存活患者百分比为78%(95%CI:70~84)克唑替尼组为39%(95%CI:30~48)(HR=0.28;95%CI:0.19~0.41;P<0.001)。男性的PFS HR为0.31(95%CI:0.18~0.34),女性为0.26(95%CI:0.16~0.44)。到目前为止,尚无生存数据公布(表3)。
两项II期试验在克唑替尼期间经历疾病进展的患者中测试了阿列替尼和一项研究布加替尼[45-47],遗憾的是,其中缺乏性别相关的数据。在日本的Ⅰ−II期试验(AF−001JP)中,患者在化疗发生疾病进展后接受阿列替尼治疗[48]。值得注意的是,在参与试验的24例女性患者中,3年无进展生存率为77%,而在22例男性患者中,同样的数字为47%。
在ASCEND-5 Ⅲ期试验中,231例先前接受化疗和克唑替尼治疗的患者被随机分配接受赛瑞替尼或化疗[49]。中位随访16.5个月后,与化疗组相比,赛瑞替尼的中位PFS显著改善(5.5 vs. 1.6个月,HR=0.49;95%CI:0.36~0.67;P<0.0001)。男性中位PFS为1.4个月(95%CI:1.2~2.1),女性中位PFS为1.8个月(95%CI:1.5~3.2);HR分别为0.41(95%CI:0.27~0.63)和0.63(95%CI:0.43~0.93)。
总之,所有比较ALK抑制剂与化疗或比较新一代ALK抑制剂与克唑替尼的研究均显示,无论性别,实验组的PFS均优于标准组。与使用EGFR TKIs的研究类似,在使用ALK抑制剂的患者中,女性PFS的风险降低幅度大于男性。Ascend−4研究在未治疗的患者中比较了赛瑞替尼与化疗,是唯一报告男性PFS的HR优于女性的研究。
结论
文献表明肺癌在男性患者和女性患者之间的发病和特征存在实质性差异[50]:女性患者更容易受到香烟烟雾中所含致癌物的影响,以及二手烟和环境吸烟的致癌作用。此外,在不吸烟的人群中,女性患肺癌的比例明显高于男性,事实上,从不吸烟的女性比从不吸烟的男性更容易患肺癌。女性性别是一个预后因素,一项包括32,000多例女性和54,000多例男性患者的荟萃分析报告称,无论分期、治疗、吸烟习惯或诊断年龄,女性的生存率均显著高于男性。性别不仅可被视为预后因素,而且可被视为获益和/或毒性的预测因素,而现在来说,治疗的选择不受患者性别的影响。
关于在接受化疗、免疫治疗或两者治疗的非成瘾性NSCLC患者中,出现了与性别相关的差异益处的有趣数据。在分子驱动的NSCLC中也可以做出一些考虑。首先,与男性相比,女性更容易出现目标驱动因素的改变。到目前为止,在这种情况下,大多数与性别和治疗益处相关的可用数据都是关于EGFR激活突变的。大多数评估EGFR TKIs活性和疗效的试验清楚地表明,无论使用哪种治疗方法,男性和女性成瘾性NSCLC患者都能从这些分子的使用中获益。尽管如此,仔细观察回顾性亚组分析,他们中的大多数报告了PFS的HR始终有利于女性患者而不是男性患者。Ascend−4试验是唯一报告PFS的HR有利于男性患者而不是女性患者的研究。这些研究的数据得到了一项荟萃分析的证实,该荟萃分析包括在一线环境中比较EGFR TKI与化疗的随机试验,该荟萃分析显示,女性患者从TKI治疗中获得的益处比男性患者高27%[27]。
为了增强EGFR受体的抑制作用和临床结果,抗血管生成抗体(雷莫西单抗或贝伐单抗)与EGFR TKI联合。尽管这两项研究都是按性别分层的,但只有NEJ026显示出对女性更有利的组合。相反,接力试验给出了相反的结果。这些相反结果的原因尚不清楚,应予以说明。
遗憾的是,尽管先前报道的结果令人感兴趣且一致性较好,但仍有少数研究将性别作为分层因素,尽管这可能会影响最终结果。此外,没有一项关于性别的前瞻性试验,排除了在临床实践中进行更适合女性生物和代谢特性的治疗的可能性。而且一些数据库中包含的患者数量有限,并且可用的原始临床数据限制了得出关于某些分子改变中性别优势的结论,或者吸烟模式是否可能是性别和分子谱之间相互作用的混杂因素。此外,评估TKIs的毒性特征是否因性别而不同是十分重要的。尽管前面提到的数据一致表明性别在致癌基因成瘾的NSCLC中具有潜在的预后和预测作用,但在缺乏前瞻性研究的情况下,得出明确结论需要非常谨慎。
Acknowledgments
We appreciate the kind invitation to contribute to the PCM series on “Lung Cancer In Women: From Epidemiology To Therapy” edited by Dr. Editta Baldini and Dr. Franca Melfi.
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the editorial office, Precision Cancer Medicine for the series “Lung Cancer In Women: From Epidemiology To Therapy”. The article has undergone external peer review.
Reporting Checklist: The authors have completed the Narrative Review reporting checklist. Available at https://pcm.amegroups.com/article/view/10.21037/pcm-21-31/rc
Peer Review File: Available at https://pcm.amegroups.com/article/view/10.21037/pcm-21-31/prf
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at https://pcm.amegroups.com/article/view/10.21037/pcm-21-31/coif). The series “Lung Cancer In Women: From Epidemiology To Therapy” was commissioned by the editorial office without any funding or sponsorship. EB served as the unpaid Guest Editor of the series and serves as an unpaid editorial board member of Precision Cancer Medicine from May 2020 to April 2022. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin 2020;70:7-30. [Crossref] [PubMed]
- Chen Z, Fillmore CM, Hammerman PS, et al. Non-small-cell lung cancers: a heterogeneous set of diseases. Nat Rev Cancer 2014;14:535-46. [Crossref] [PubMed]
- Howlader N, Forjaz G, Mooradian MJ, et al. The Effect of Advances in Lung-Cancer Treatment on Population Mortality. N Engl J Med 2020;383:640-9. [Crossref] [PubMed]
- Kim HI, Lim H, Moon A. Sex Differences in Cancer: Epidemiology, Genetics and Therapy. Biomol Ther (Seoul) 2018;26:335-42. [Crossref] [PubMed]
- Gabriele L, Buoncervello M, Ascione B, et al. The gender perspective in cancer research and therapy: novel insights and on-going hypotheses. Ann Ist Super Sanita 2016;52:213-22. [PubMed]
- Klein SL, Flanagan KL. Sex differences in immune responses. Nat Rev Immunol 2016;16:626-38. [Crossref] [PubMed]
- Zang EA, Wynder EL. Differences in lung cancer risk between men and women: examination of the evidence. J Natl Cancer Inst 1996;88:183-92. [Crossref] [PubMed]
- Cook MB, McGlynn KA, Devesa SS, et al. Sex disparities in cancer mortality and survival. Cancer Epidemiol Biomarkers Prev 2011;20:1629-37. [Crossref] [PubMed]
- Giaccone G, Herbst RS, Manegold C, et al. Gefitinib in combination with gemcitabine and cisplatin in advanced non-small-cell lung cancer: a phase III trial--INTACT 1. J Clin Oncol 2004;22:777-84. [Crossref] [PubMed]
- Herbst RS, Giaccone G, Schiller JH, et al. Gefitinib in combination with paclitaxel and carboplatin in advanced non-small-cell lung cancer: a phase III trial--INTACT 2. J Clin Oncol 2004;22:785-94. [Crossref] [PubMed]
- Gatzemeier U, Pluzanska A, Szczesna A, et al. Phase III study of erlotinib in combination with cisplatin and gemcitabine in advanced non-small-cell lung cancer: the Tarceva Lung Cancer Investigation Trial. J Clin Oncol 2007;25:1545-52. [Crossref] [PubMed]
- Herbst RS, Prager D, Hermann R, et al. TRIBUTE: a phase III trial of erlotinib hydrochloride (OSI-774) combined with carboplatin and paclitaxel chemotherapy in advanced non-small-cell lung cancer. J Clin Oncol 2005;23:5892-9. [Crossref] [PubMed]
- Bell DW, Lynch TJ, Haserlat SM, et al. Epidermal growth factor receptor mutations and gene amplification in non-small-cell lung cancer: molecular analysis of the IDEAL/INTACT gefitinib trials. J Clin Oncol 2005;23:8081-92. [Crossref] [PubMed]
- Shigematsu H, Lin L, Takahashi T, et al. Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancers. J Natl Cancer Inst 2005;97:339-46. [Crossref] [PubMed]
- Tanaka T, Matsuoka M, Sutani A, et al. Frequency of and variables associated with the EGFR mutation and its subtypes. Int J Cancer 2010;126:651-5. [Crossref] [PubMed]
- Kong A, Gudbjartsson DF, Sainz J, et al. A high-resolution recombination map of the human genome. Nat Genet 2002;31:241-7. [Crossref] [PubMed]
- Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009;361:947-57. [Crossref] [PubMed]
- Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small cell lung cancer with mutated EGFR. N Engl J Med 2010;362:2380-8. [Crossref] [PubMed]
- Mitsudomi T, Morita S, Yatabe Y, et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol 2010;11:121-8. [Crossref] [PubMed]
- Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol 2011;12:735-42. [Crossref] [PubMed]
- Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2012;13:239-46. [Crossref] [PubMed]
- Wu YL, Zhou C, Liam CK, et al. First-line erlotinib versus gemcitabine/cisplatin in patients with advanced EGFR mutation-positive non-small-cell lung cancer: analyses from the phase III, randomized, open-label, ENSURE study. Ann Oncol 2015;26:1883-9. [Crossref] [PubMed]
- Sequist LV, Yang JC, Yamamoto N, et al. Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 2013;31:3327-34. [Crossref] [PubMed]
- Wu YL, Zhou C, Hu CP, et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol 2014;15:213-22. [Crossref] [PubMed]
- Wu YL, Cheng Y, Zhou X, et al. Dacomitinib versus gefitinib as first-line treatment for patients with EGFR-mutation-positive non-small-cell lung cancer (ARCHER 1050): a randomised, open-label, phase 3 trial. Lancet Oncol 2017;18:1454-66. [Crossref] [PubMed]
- Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer. N Engl J Med 2018;378:113-25. [Crossref] [PubMed]
- Rosell R, Moran T, Queralt C, et al. Screening for epidermal growth factor receptor mutations in lung cancer. N Engl J Med 2009;361:958-67. [Crossref] [PubMed]
- Lee CK, Wu YL, Ding PN, et al. Impact of Specific Epidermal Growth Factor Receptor (EGFR) Mutations and Clinical Characteristics on Outcomes After Treatment With EGFR Tyrosine Kinase Inhibitors Versus Chemotherapy in EGFR-Mutant Lung Cancer: A Meta-Analysis. J Clin Oncol 2015;33:1958-65. [Crossref] [PubMed]
- Ramalingam SS, Vansteenkiste J, Planchard D, et al. Overall Survival with Osimertinib in Untreated, EGFR-Mutated Advanced NSCLC. N Engl J Med 2020;382:41-50. [Crossref] [PubMed]
- Shepherd FA, Rodrigues Pereira J, Ciuleanu T, et al. Erlotinib in previously treated non-small-cell lung cancer. N Engl J Med 2005;353:123-32. [Crossref] [PubMed]
- Kim ES, Hirsh V, Mok T, et al. Gefitinib versus docetaxel in previously treated non-small-cell lung cancer (INTEREST): a randomised phase III trial. Lancet 2008;372:1809-18. [Crossref] [PubMed]
- Nakagawa K, Garon EB, Seto T, et al. Ramucirumab plus erlotinib in patients with untreated, EGFR-mutated, advanced non-small-cell lung cancer (RELAY): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2019;20:1655-69. [Crossref] [PubMed]
- Saito H, Fukuhara T, Furuya N, et al. Erlotinib plus bevacizumab versus erlotinib alone in patients with EGFR-positive advanced non-squamous non-small-cell lung cancer (NEJ026): interim analysis of an open-label, randomised, multicentre, phase 3 trial. Lancet Oncol 2019;20:625-35. [Crossref] [PubMed]
- Fan L, Feng Y, Wan H, et al. Clinicopathological and demographical characteristics of non-small cell lung cancer patients with ALK rearrangements: a systematic review and meta-analysis. PLoS One 2014;9:e100866. [Crossref] [PubMed]
- Fallet V, Cadranel J, Doubre H, et al. Prospective screening for ALK: clinical features and outcome according to ALK status. Eur J Cancer 2014;50:1239-46. [Crossref] [PubMed]
- Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med 2014;371:2167-77. [Crossref] [PubMed]
- Soria JC, Tan DSW, Chiari R, et al. First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer (ASCEND-4): a randomised, open-label, phase 3 study. Lancet 2017;389:917-29. [Crossref] [PubMed]
- Hida T, Nokihara H, Kondo M, et al. Alectinib versus crizotinib in patients with ALK-positive non-small-cell lung cancer (J-ALEX): an open-label, randomised phase 3 trial. Lancet 2017;390:29-39. [Crossref] [PubMed]
- Peters S, Camidge DR, Shaw AT, et al. Alectinib versus Crizotinib in Untreated ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2017;377:829-38. [Crossref] [PubMed]
- Camidge DR, Kim HR, Ahn MJ, et al. Brigatinib versus Crizotinib in ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2018;379:2027-39. [Crossref] [PubMed]
- Shaw AT, Bauer TM, de Marinis F, et al. First-Line Lorlatinib or Crizotinib in Advanced ALK-Positive Lung Cancer. N Engl J Med 2020;383:2018-29. [Crossref] [PubMed]
- Shaw AT, Kim DW, Nakagawa K, et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. N Engl J Med 2013;368:2385-94. [Crossref] [PubMed]
- Mok T, Camidge DR, Gadgeel SM, et al. Updated overall survival and final progression-free survival data for patients with treatment-naive advanced ALK-positive non-small-cell lung cancer in the ALEX study. Ann Oncol 2020;31:1056-64. [Crossref] [PubMed]
- Camidge DR, Kim HR, Ahn MJ, et al. Brigatinib Versus Crizotinib in Advanced ALK Inhibitor-Naive ALK-Positive Non-Small Cell Lung Cancer: Second Interim Analysis of the Phase III ALTA-1L Trial. J Clin Oncol 2020;38:3592-603. [Crossref] [PubMed]
- Shaw AT, Gandhi L, Gadgeel S, et al. Alectinib in ALK-positive, crizotinib-resistant, non-small-cell lung cancer: a single-group, multicentre, phase 2 trial. Lancet Oncol 2016;17:234-42. [Crossref] [PubMed]
- Ou SH, Ahn JS, De Petris L, et al. Alectinib in Crizotinib-Refractory ALK-Rearranged Non-Small-Cell Lung Cancer: A Phase II Global Study. J Clin Oncol 2016;34:661-8. [Crossref] [PubMed]
- Huber RM, Hansen KH, Paz-Ares Rodríguez L, et al. Brigatinib in Crizotinib-Refractory ALK+ NSCLC: 2-Year Follow-up on Systemic and Intracranial Outcomes in the Phase 2 ALTA Trial. J Thorac Oncol 2020;15:404-15. [Crossref] [PubMed]
- Tamura T, Kiura K, Seto T, et al. Three-Year Follow-Up of an Alectinib Phase I/II Study in ALK-Positive Non-Small-Cell Lung Cancer: AF-001JP. J Clin Oncol 2017;35:1515-21. [Crossref] [PubMed]
- Shaw AT, Kim TM, Crinò L, et al. Ceritinib versus chemotherapy in patients with ALK-rearranged non-small-cell lung cancer previously given chemotherapy and crizotinib (ASCEND-5): a randomised, controlled, open-label, phase 3 trial. Lancet Oncol 2017;18:874-86. [Crossref] [PubMed]
- Novello S, Baldini E. Women and lung cancer. Ann Oncol 2006;17:ii79-82. [Crossref] [PubMed]
王菲
复旦大学附属肿瘤医院(更新时间:2023-05-05)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Tibaldi C, Stasi I, Baldini E. Oncogene-addicted non-small-cell lung cancer in women: a narrative review of the importance of gender-related differences in treatment outcome. Precis Cancer Med 2022;5:6.

