罕见EGFR突变:最新技术和病例报告
介绍
除EGFR 19外显子缺失和21外显子L858R替换以外的EGFR突变被定义为罕见突变。罕见突变包括多种基因改变,包括20外显子插入、18外显子和19外显子点突变。在高达25%的罕见EGFR突变病例中,单个肿瘤样本中检测到两个或多个不同的EGFR突变被定义为复杂突变[1]。一些来自回顾性数据收集、临床病例报告和少数前瞻性研究的临床数据显示,在携带罕见突变的患者中,EGFR−酪氨酸激酶抑制剂(TKI)的临床活性是不可预测的[2,3]。
在临床上,携带罕见EGFR突变的患者往往与携带经典突变的患者不同,因为它们在吸烟者中的发病率更高。这可能部分解释了TKI在罕见突变中的临床活性不一致,因为众所周知,吸烟状态是预测EGFR−TKI活性的阴性驱动指标[4,5]。
尽管来自大型随机临床试验的可靠数据显示了EGFR TKIs在携带常见EGFR突变的患者中的疗效和耐受性益处,但在罕见突变中可用的前瞻性数据很少且具有异质性。迄今为止,已发表的EGFR TKI Ⅲ期随机试验中只有关于吉非替尼(IPASS和NEJ002研究)和阿法替尼(LUX−Lung 3研究和LUX−Lung 6研究)的研究中纳入了少数罕见EGFR突变患者[6,7]。特别地,在LUX−Lung试验的回顾性分析和荟萃分析中,证明了阿法替尼对最常见的18外显子和21外显子罕见突变(G719X和L861Q)的临床活性[3,8,9]。
此外,最近在EGFR 20外显子插入突变经治患者中进行的小型1/2期临床试验的结果推动了美国食品和药物管理局(FDA)对新的小分子TKI mobocertinib[10]的突破性治疗批准。在最近的Ⅰ/Ⅱ期试验[11,12]中,poziotinib和amivantanab对携带EGFR 20外显子突变的非小细胞肺癌(NSCLC)患者也显示出临床活性。
目前缺乏可靠的前瞻性数据,但几项回顾性分析表明,EGFR−TKI在携带罕见突变的肿瘤患者中的临床活,总体上是不可预测的[2]。
此外,第三代EGFR−TKI奥希替尼已被批准作为携带常见EGFR突变的NSCLC患者的前线标准治疗选择[13]。但是,对于奥希替尼,罕见EGFR突变的预测作用数据很少。奥希替尼的Ⅲ期试验仅招募了携带常见敏感突变(19外显子缺失和21外显子L858R替换)的NSCLC患者[13,14]。在一项小型Ⅱ期试验中,36例携带罕见EGFR突变的NSCLC患者接受了前线奥希替尼治疗,显示出令人鼓舞的疗效和可控的毒性[15]。
总之,在携带罕见EGFR突变的情况下,对于前线治疗的有效临床决策具有挑战性,因为仅存在来自小型前瞻性试验的有限证据支持,并且临床选择的结果是不可预测的。
在这里,我们报告了一例携带20外显子突变的晚期NSCLC患者病例,吸烟,接受前线奥希替尼治疗后出现部分反应;以及一名携带18外显子突变患者的病例,不吸烟,接受第三代EGFR−TKI前线治疗失败。
我们根据CARE报告清单,提供了以下案例(可在https://pcm.amegroups.com/article/view/10.21037/pcm-21-20/rc获得)。
案例展示
案例1——携带EGFR 20外显子罕见突变患者对奥希替尼有良好的部分疾病反应
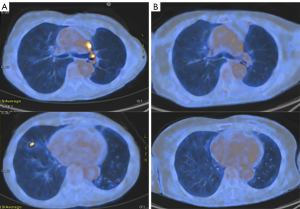
一位吸烟(30包年)的64岁家庭主妇于2016年1月被诊断为Ⅱb期(cT2a cN1)肺腺癌。无其他相关疾病,无癌症家族史。患者于2016年2月接受了右上肺叶切除术,随后给予顺铂和长春瑞滨4周期辅助化疗。2018年11月CT扫描及2018年12月PET−CT均显示,患者纵隔主动脉旁疾病复发,并伴有新肺淋巴结转移。原发肿瘤EGFR(18、19、20和21外显子)、ALK和ROS−1基因的分子分析显示,患者携带罕见EGFR突变(20外显子 D770 N771 insG)。DAKO ALK和ROS−1 D4D6 ICH 均为阴性。DAKO PDL−1 ICH 22 C3亦为阴性(肿瘤比例评分0%)。
笔者与患者讨论了治疗方案。特别的是,提出了与第二代/第三代TKI相比的前线化疗。由于患者要求接受不良事件风险较低的治疗方案,并于2019年2月18日开始前线奥希替尼治疗,剂量80 mg/天,未发生不良事件。2019年5月1日,重新分期PET−CT显示患者的治疗反应几乎为疾病完全缓解(图1)。该患者仍在接受全剂量治疗,没有影像学进展迹象(末次随访时间为2021年5月24日)。
病例2——携带EGFR 18外显子罕见突变患者前线奥希替尼治疗后疾病进展
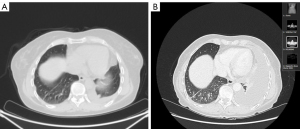
一名65岁白人退休教师,无吸烟史,无环境暴露史,于2018年9月被诊断为Ⅲa期(cT4 叶内淋巴结,cN0)肺腺癌。患者患有多种相关的心血管疾病,包括高血压和心房颤动,但无限制性肺病,无癌症家族史。患者于2015年2月接受了左下肺叶切除术,随后接受了顺铂和长春瑞滨3周期辅助化疗。在辅助治疗期间,患者经历了不良事件通用术语标准(common terminology criteria for adverse events, CTCAE)2级腹泻和3级发热性中性粒细胞减少症。随访期间,2019年10月CT扫描发现胸膜进展。对原发灶进行FoundationOne®CDx二代测序分析,报告了EGFR 18外显子突变delE709_T710insD,其他疾病相关基因无突变。DAKO PDL-1 ICH 22 C3 为阴性(肿瘤比例评分0%)。
在与患者讨论了第二代阿法替尼和第三代奥希替尼的治疗方案后,主要考虑到阿法替尼的胃肠道毒性,患者于202年2月2日开始奥希替尼前线治疗,剂量80 mg/天。治疗一个月后,患者仅有CTCAE 1级腹泻,治疗耐受性好。在2020年4月末(治疗12周后)进行的第一次疾病评估中,患者出现了胸膜疾病进展,并暂停奥希替尼治疗(图2)。二线化疗联合免疫治疗于2020年6月开始,方案为卡铂、紫杉醇、贝伐单抗联合阿特珠单抗。在重新分期CT扫描时显示为部分缓解,但2020年11月出现胸膜进展。培美曲塞的三线治疗(2021年1月−2021年3月)临床或影像学未获益。患者仍健在,目前仅接受最佳支持性护理(末次随访时间2021年6月4日)。
对于以上两例报告,本研究中执行的所有程序均符合机构和国家研究委员会的道德标准以及赫尔辛基宣言(2013年修订)。从患者处获得了书面知情同意书,以出版本病例报告和随附的图像。本刊编辑部可提供书面同意书副本供审阅。
讨论
关于EGFR−TKIs在携带罕见EGFR突变的NSCLC患者中疗效的临床数据有限。很少有前瞻性数据和大型回顾性分析证明,第二代EGFR−TKI能在携带罕见突变肿瘤患者中发挥作用[2]。特别的是,对阿法替尼的3项前瞻性临床试验的回顾性分析表明,阿法替尼在携带某些罕见EGFR突变(包括携带18外显子和21外显子的复杂突变)的NSCLC患者中具有良好疗效[3]。
此外,第一批临床数据表明第三代奥希替尼具有更好的耐受性和药物活性,被认为是携带经典突变的非小细胞肺癌的标准治疗。关于罕见突变,在一项纳入19例18外显子G719X突变和8例20外显子S768I突变患者的小型Ⅱ期试验中,奥希替尼对罕见的EGFR突变显示出有希望的抗肿瘤活性[15]。
在这里,我们报告了两例在不常见的EGFR突变情况下使用奥希替尼进行前期药物治疗且临床结果相反的病例。这强调了在罕见EGFR突变下作出有效治疗决策的困难,以及对定期更新、易于访问的、含有对罕见EGFR突变具有预测价值的临床数据的数据库的临床需求。
结论
对携带罕见EGFR突变的NSCLC患者的治疗决策具有挑战性。无论吸烟状况如何,第二代阿法替尼和第三代奥希替尼都可能发挥治疗作用,但缺乏足够证据确定最佳治疗策略。因此,需要文献报道这些罕见突变及其在大型更新数据库中对EGFR−TKI反应的预测作用,以指导临床医生为NSCLC患者制定个性化治疗策略。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor (Marco Russano) for the series “Uncommon Mutations in Non-Small Cell Lung Cancer” published in Precision Cancer Medicine. The article has undergone external peer review.
Reporting Checklist: The authors have completed the CARE reporting checklist. Available at https://pcm.amegroups.com/article/view/10.21037/pcm-21-20/rc
Peer Review File: Available at https://pcm.amegroups.com/article/view/10.21037/pcm-21-20/prf
Conflicts of Interest: Both authors have completed the ICMJE uniform disclosure form (available at https://pcm.amegroups.com/article/view/10.21037/pcm-21-20/coif). The series “Uncommon Mutations in Non-Small Cell Lung Cancer” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved. All procedures performed in this study were in accordance with the ethical standards of the institutional and national research committees and with the Helsinki Declaration (as revised in 2013). Written informed consents were obtained from the patients for publication of this case report and accompanying images. Copy of written consents are available for review by the editorial office of this journal.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Wu JY, Yu CJ, Chang YC, et al. Effectiveness of tyrosine kinase inhibitors on “uncommon” epidermal growth factor receptor mutations of unknown clinical significance in non-small cell lung cancer. Clin Cancer Res 2011;17:3812-21. [Crossref] [PubMed]
- Beau-Faller M, Prim N, Ruppert AM, et al. Rare EGFR exon 18 and exon 20 mutations in non-small-cell lung cancer on 10 117 patients: a multicentre observational study by the French ERMETIC-IFCT network. Ann Oncol 2014;25:126-31. [Crossref] [PubMed]
- Yang JC, Sequist LV, Geater SL, et al. Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6. Lancet Oncol 2015;16:830-8. [Crossref] [PubMed]
- Kim MH, Kim HR, Cho BC, et al. Impact of cigarette smoking on response to epidermal growth factor receptor (EGFR)-tyrosine kinase inhibitors in lung adenocarcinoma with activating EGFR mutations. Lung Cancer 2014;84:196-202. [Crossref] [PubMed]
- Tu HY, Ke EE, Yang JJ, et al. A comprehensive review of uncommon EGFR mutations in patients with non-small cell lung cancer. Lung Cancer 2017;114:96-102. [Crossref] [PubMed]
- Fukuoka M, Wu YL, Thongprasert S, et al. Biomarker analyses and final overall survival results from a phase III, randomized, open-label, first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia (IPASS). J Clin Oncol 2011;29:2866-74. [Crossref] [PubMed]
- Inoue A, Kobayashi K, Maemondo M, et al. Updated overall survival results from a randomized phase III trial comparing gefitinib with carboplatin-paclitaxel for chemo-naïve non-small cell lung cancer with sensitive EGFR gene mutations (NEJ002). Ann Oncol 2013;24:54-9. [Crossref] [PubMed]
- Yang JC, Schuler M, Popat S, et al. Afatinib for the Treatment of NSCLC Harboring Uncommon EGFR Mutations: A Database of 693 Cases. J Thorac Oncol 2020;15:803-15. [Crossref] [PubMed]
- Tanaka I, Morise M, Kodama Y, et al. Potential for afatinib as an optimal treatment for advanced non-small cell lung carcinoma in patients with uncommon EGFR mutations. Lung Cancer 2019;127:169-71. [Crossref] [PubMed]
- Riely GJ, Neal JW, Camidge DR, et al. Activity and Safety of Mobocertinib (TAK-788) in Previously Treated Non-Small Cell Lung Cancer with EGFR Exon 20 Insertion Mutations from a Phase I/II Trial. Cancer Discov 2021;11:1688-99. [Crossref] [PubMed]
- Elamin YY, Robichaux JP, Carter BW, et al. Poziotinib for Patients With HER2 Exon 20 Mutant Non-Small-Cell Lung Cancer: Results From a Phase II Trial. J Clin Oncol 2021; Epub ahead of print. [Crossref] [PubMed]
- Park K, Haura EB, Leighl NB, et al. Amivantamab in EGFR Exon 20 Insertion-Mutated Non-Small-Cell Lung Cancer Progressing on Platinum Chemotherapy: Initial Results From the CHRYSALIS Phase I Study. J Clin Oncol 2021;39:3391-402. [Crossref] [PubMed]
- Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer. N Engl J Med 2018;378:113-25. [Crossref] [PubMed]
- Mok TS, Wu Y-L, Ahn M-J, et al. Osimertinib or Platinum-Pemetrexed in EGFR T790M-Positive Lung Cancer. N Engl J Med 2017;376:629-40. [Crossref] [PubMed]
- Cho JH, Lim SH, An HJ, et al. Osimertinib for Patients With Non-Small-Cell Lung Cancer Harboring Uncommon EGFR Mutations: A Multicenter, Open-Label, Phase II Trial (KCSG-LU15-09). J Clin Oncol 2020;38:488-95. [Crossref] [PubMed]
张思维
复旦大学附属肿瘤医院(更新时间:2023-05-05)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Simionato F, Calvetti L. Uncommon EGFR mutations: state-of-the-art and case reports. Precis Cancer Med 2022;5:9.