克唑替尼或第二代ALK治疗晚期非小细胞肺癌后的耐药机制
介绍
间变性淋巴瘤激酶(ALK)基因重排发生在约5%的晚期非小细胞肺癌(NSCLC)患者中,主要发生在肺腺癌中。第一代ALK−酪氨酸激酶抑制剂(TKI)、克唑替尼和最近的下一代ALK−TKI(第二代:西利替尼、恩沙替尼、阿雷替尼、布格替尼和第三代:洛拉替尼)显著扩大了该人群的治疗库。克唑替尼是FDA(2011年)和EMA(2012年)批准的第一种ALK−TKI,作为患有ALK重排的肺癌的标准治疗。在一线设置中,在两项随机Ⅲ期临床试验中,与基于铂的化疗相比,克唑替尼改善了应答率(RR)和无进展生存率(PFS),前者仅在亚洲患者中进行。类似的,Ⅲ期ASCEND−4试验[4]证实了与化疗相比,在同一患者亚群中ceritinib的疗效。然而,在ALEX试验[5-6]中使用阿来替尼和ALTA−1L试验[7-8]中使用布里加替尼后,PFS显著改善,颅内活动显著增加,一线治疗策略发生了变化。如今,这两种药物都是一线护理的新标准。阿来替尼于2017年10月12日获得EMA批准,并于2017年11月6日获得FDA批准,而在同一环境中,布格替尼仅于2020年5月26日获得FDA的批准。最近,在ALEX试验的最新总生存率(OS)中,首次报道了下一代ALK TKI与克唑替尼相比,在治疗ALK阳性的NSCLC患者时,其OS益处,阿来替尼的临床意义5年生存率为63%,而环唑替尼为46%[6]。最近,晚期ALK阳性晚期非小细胞肺癌Ⅲ期ELECT试验报告,与克唑替尼相比,恩沙替尼的PFS显著延长(25.8个月VS12.7个月,HR 0.51;95%CI:0.35~0.72),这增加了一种新的潜在一线治疗策略。在未来,在这组患者中,正在进行的Ⅲ期冠状动脉试验(洛拉替尼与克唑替尼)的结果可能再次改变治疗模式。这些药物的疗效和毒性曲线比率以及颅内活动可能与一线治疗决策相关。
液体活检确定ALK NSCLC获得性耐药(AR)的机制
在ALK阳性的NSCLC患者中,尽管最初对ALK−TKI有反应,但大多数患者疾病最终还是会有所进展,获得性TKI耐药可能是由于ALK依赖。值得注意的是,酪氨酸激酶内ALK突变是AR到ALK TKI的主要机制,在环唑替尼难治性患者中观察到高达三分之一的突变,在第二代ALK−TKI进展患者中,观察到56%的突变[9]。因此,序贯ALK−TKI可能是AR时的最佳治疗方案。在PROFILE 1014试验中,进展期(PD)接受后续ALK−TKI的克唑替尼难治性患者的OS最长,与未接受后续个性化治疗的患者的25%相比,4年OS为80%[2],这说明序贯策略对改善患者的预后有影响。类似的,法国临床回顾性研究[10]和其他队列研究[11]报告,对于那些在前期克唑替尼治疗策略中接受不同ALK−TKI的患者,从转移性疾病诊断开始,中位生存期长达7.5年。
在克唑替尼难治人群中,所有下一代ALK−TKI(布列格替尼、恩沙替尼、西替尼、洛拉替尼)均报告有作用[12-16]。事实上,在克唑替尼难治性肿瘤中,下一代ALK−TKI的疗效与获得性ALK突变的发生无关[15,17-19],这支持在克唑替尼进展期的盲法序贯策略。然而,基于ALEX[5-6]和ALTA−1L[7-8]研究的最新结果,第二代ALK−TKI的前期给药策略质疑了当前的ALK−TKI序贯策略。事实上,在前一代ALK−TKI的基础上进行第二代ALK−TKI治疗时,采用盲法序贯治疗策略不是最合适的治疗策略[20]。
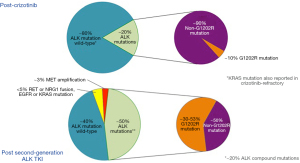
ALK−TKI进展时的最佳序贯治疗策略可能是有意义的,因为每个ALK−TKI似乎与特定获得的ALK突变谱相关。这对于获得性的G1202R ALK突变非常有价值,该突变造成了对第一代和第二代ALK TKI的高水平抗性。尽管在环唑替尼后(2%)肿瘤样本中发生G1202R突变并不常见[9],但在进展期,第二代ALK−TKI治疗会有多达50%的肿瘤发生G1202R突变[15]。事实上,根据之前的第二代ALK−TKI(赛瑞替尼后21%,阿来替尼后29%,布格替尼后43%),其发生率不同[9],目前只能通过洛拉替尼有效克服[15]。因此,由于并非所有第二代ALK−TKI都能均匀绕过所有获得的ALK突变[9],因此,进展期的肿瘤基因分型可能有助于实施量身定制的方法。然而,近三分之一的晚期非小细胞肺癌患者没有足够的肿瘤组织进行基因组分析[21],液体活检(循环肿瘤DNA、ctDNA分析)是非小细胞癌基因组分析的可靠替代工具[22]。在一些ALK队列中,76%的血浆样本含有足够的肿瘤衍生DNA用于分子分析,而活检样本的比例为65%,这两种方法都是可靠的[23]。在ALK阳性的NSCLC中,与其他致癌成瘾的NSCLC类似,液体活检有助于了解基线或进展时的广泛基因组图谱[15,23-18]。它们也有助于基于纵向cDNA分析[23]监测ALK TKI的抗性机制的动态演变,从而根据ALK突变抗性图谱[23,29]提供个性化治疗方法。然而,检测基因组改变的液体活检敏感性与临床因素密切相关,如分期和转移性肿瘤负荷,这表明血浆基因分型遗漏的病例中肿瘤DNA的脱落有限[30]。
目前,大多数检测ctDNA中ALK突变的报告都是通过下一代测序(NGS)进行的。此外,必须涵盖的广泛突变和即将推出的新药数量表明,NGS将是从ctDNA中确定ALK突变的最佳方法[31]。最近,据报道,在新发肿瘤组织活检中使用ALK突变状态作为参考,对任何ALK突变进行NGS血浆基因分型的敏感性和特异性分别为61%和82%,总体一致性为73%[15]。然而,在其他系列中,基于扩增子的NGS[25]或混合捕获NGS[23]的一致率已达到100%。事实上,与单部位活检标本相反,液体活检可以捕获肿瘤亚克隆中可能存在的ALK突变的空间异质性[23-25],甚至可以提供高于组织分析的优势。
ALK−TKI失败后ctDNA中ALK突变的检测率在11%~到66%之间,这取决于先前ALK−TKI的效力[15,23,25-27],下一代ALK−TKI后ALK突变发生率更高[25,27]。事实上,与第二代ALK−TKI相比,≥2个ALK突变在洛拉替尼复发患者中更为常见(48%VS23%,P=0.017),ctDNA分析而非组织分析具有更高的识别这些化合物突变的能力[27]。最后,在ALK−TKI失败时检测ctDNA可能与疾病的预后相关。在一项探索性分析中,与至少有一个ALK突变的患者相比,ctDNA突变缺失与改善预后相关(中位OS:105个月VS58.5个月,P=0.001),这种效应可能与较低的肿瘤负荷或较低的异质性肿瘤有关[25]。
除ALK突变外,液体活检中还报道了其他作为AR机制的突变,如MET扩增。当使用组织作为参考时,对于检测MET扩增,血浆基因分型显示了100%敏感性、95%特异性和80%阳性预测值[28]。
ALK阳性患者的ALK−TKI颅内进展是一个真正的挑战[32]。对于孤立性颅内进展的患者,通过ctDNA分析检测基因组改变的检出率低于其他进展转移部位的患者[33]。值得注意的是,只有10%的孤立性中枢神经系统(CNS)复发病例(N=3/29)检测到ctDNA ALK突变,而肝或骨转移患者的ctDNA分析检测到约75%的ALK突变[25]。相反,另一个队列报告了89%的局限性颅内或胸腔内复发患者的ALK突变和/或ALK融合(N=17/19)[27]。颅内或胸腔内复发进行的亚组分析未被提供。值得注意的是,腰椎穿刺和脑脊液基因分型也正在成为孤立性颅内进展患者的一种选择[34-35]。在可能的情况下,建议在血浆谱阴性的情况下进行肿瘤再次活检以进行基因分型,并排除组织学转变作为耐药机制[36-38]。
克唑替尼后液体活检
在注册洛拉替尼的多中心Ⅱ期研究中,从198例名ALK阳性的NSCLC患者中收集了处于基线状态的血浆和肿瘤样本。血浆cDNA通过二代测序分析(Guardant 360),肿瘤组织则在Molecular MD (Portland, OR)的Torrent PGM平台使用一个中心化的商用二代测序方法分子MD(波特兰,俄勒冈州)的Ion Torrent PGM平台上的中央定制NGS分析进行分析。59例患者曾接受过环唑替尼+/‒化疗(27例患者仅接受过环佐替尼,32例患者接受过环佐替尼和化疗),而139例患者接受了一种或多种第二代ALK−TKI,通常在第二代ALK抑制剂之前使用环唑替宁。在整个研究队列中,在189例具有基线血浆基因分型的ALK阳性患者中,24%的患者在ctDNA中检测到一种或多种ALK突变,21%的患者没有检测到ctDNA[15]。在组织中,在198个肿瘤样本(存档和从头活检)中检测到24%的ALK突变,然而,在从头测序的肿瘤样本中,ALK突变发生率达到47%。在本研究中,TKI治疗失败时,约25%的ctDNA ALK突变检测率[15]与其他队列中报告的数据[25]相似,但低于在组织中进行分析的结果,这可能是因为肿瘤没有扩散进入血液。
在洛拉替尼研究的整个队列中,基于血浆基因分型,最常见的ALK突变为G1202R(42%)、L1196M(24%)、F1174X(24%)、G1269A(18%)和I1171X(11%)。然而,根据之前的ALKTKI,在克唑替尼后的情况下59例患者中有11例(19%)有可检测到的ALK突变,44例患者(77%)没有,最常见的ALK基因突变是G1269A、F1174X和L1196M,而G1202R突变则在少数病例中检测到。在环唑替尼治疗后的情况下,无论是否存在可检测的ctDNA ALK突变,洛拉替尼都呈现出一定的疗效(图1)。洛拉替尼在突变阳性患者中的RR值为73%,在突变阴性患者中为75%,这两个亚组之间的中位PFS无差异[NR分别为12.5个月;HR为1.38,95%CI:0.48~3.98][15]。在其他两组克唑替尼难治性患者中,通过ctDNA分析评估的ALK突变在高达29%的病例中被识别[24,26],其中最常见的是L1196M[26]、G1269A和S1206F[24]。相反,在另一个队列中,基于扩增子的二代测序分析报告了克唑替尼后患者中11%的ALK突变(包括1例G1202R)。在全球范围内,克唑替尼耐药病例中ALK突变的发生率较低(15%~20%)。克唑替尼治疗后ALK突变发生率的差异可能是由于不同基因组分析检测ALK突变时存在不同的阈值敏感性。这些数据进一步表明,耐克唑替尼的肿瘤,包括那些没有检测到ALK突变的肿瘤,仍然由ALK驱动,并对更有效的ALK抑制剂保持反应。在这种情况下,所有下一代ALK−TKI都有疗效[12-16],这使基因组分析在克唑替尼难治性肿瘤中的实用性受到质疑。虽然第二代ALK−TKI之间没有直接比较,但疗效也可能存在一些差异[39]。正在进行的ALTA−3试验(NCT03596866)评估了布格替尼与阿来替尼在环唑替尼难治性ALK阳性NSCLC患者中的疗效,并可能有助于阐明这些患者对应的最佳序贯治疗策略。尽管在克唑替尼治疗后获得性G1202R突变的发生率较低,但这种情况下的基因组分析可能是有用的,因为如果发生这种突变,它可能会建议使用洛拉替尼进行序贯治疗。
在ctDNA分析中,除ALK突变外,还报道了克唑替尼的AR机制。根据ddPCR进行cfDNA检测,在20例环唑替尼难治性患者中有10例发生KRAS突变(分别为7例p.G12D、2例p.G2V和1例p.G.2C突变)。在3例患者中,KRAS突变与ALK突变相关。在用第二代ALK抑制剂治疗期间检测了ctDNA,并发现ALK或KRAS突变的数量随着肿瘤消退而减少[40]。在组织或液体活检基因分型中,9%的肿瘤中MET扩增仅作为克唑替尼难治性患者获得性耐药发生的机制[28]。
下一代ALK-TKI后的液体活检
目前,第二代ALK-TKI后的序贯治疗策略的制定仍具有挑战性,因为并非所有可用的ALK-TKI都在这种情况下具有效用,G1202R突变的高风险也可能限制潜在的序贯策略制定[9]。在先前第二代ALK-TKI的基础上,采用第二代ALK-TKI的盲法序贯ALK-TKI策略报告的结果疗效有限(RR值约为30%,中位PFS约为4个月)[20]。正在进行的Ⅱ期ALTA2试验(NCT03535740)评估了阿来替尼或西替尼治疗难治性ALK阳性非小细胞肺癌患者的布格替尼疗效,这可能有助于进一步确定第二代ALK TKI治疗失败后采用布格替尼盲法序贯策略的作用。
第二代ALK-TKI后产生获得性耐药机制的证据显示,在二线环境中这些药物进展后的组织或液体活检中,高达50%的病例[41]出现ALK依赖性耐药或ALK非依赖性耐药(图1)。在一线环境中使用第二代ALK-TKI时,耐药模式是否会有所不同尚不清楚,这是一个挑战,因为这些药物会影响治疗ALK阳性NSCLC患者的新标准。
ALK突变是第二代ALK TKI后产生获得性耐药的关键驱动因素,液体活检的发病率为27%~66%[23-25,27],而在30%~53%的病例中都检测到了最常见的获得性ALK突变G1202R[15,23,27]。同样,不管这些患者之前使用的第二代ALK-TKI的数量(一代和多代ALK-TKI分别为25%和19%,P<0.743),多达25%的血浆样本都含有≥2个ALK突变[27]。当在同一时间段两次收集样本进行活检时,根据组织或血浆基因分型,由于发生继发性ALK突变而再次使用第二代ALK-TKI的患者比例相似[15,27]。在阿来替尼耐药肿瘤中,67%和63%的患者在血浆或组织基因分型中分别存在ALK突变。阿来替尼难治性肿瘤中血浆与组织基因型的ALK突变包括G1202R(37%VS24%)、I1171X(26%VS24%),L1196M(22%VS2%)和V1180L(11%VS10%)。然而,对于ALK突变大于等于2的基因型来说,血浆基因分型比组织基因分型具有更强的检出能力。(血浆中为24%,组织中为2%,P<0.004)[27]。这是有用的,因为复合ALK突变与较短的PFS和OS[25]相关,这些复合突变可能会影响洛拉替尼的疗效。与仅有一个ALK突变的患者相比,在组织中检测到的复合ALK突变对洛拉替尼的RR较低(分别为56%和75%),中位反应持续时间较短(分别为6.1个月和24.4个月)。由于基于血浆基因分型的数量较少,因此未对ctDNA中的这种相关性进行评估[15]。事实上,一些复合ALK突变降低了洛拉替尼的序贯疗效[42]。因此,这些突变的鉴定对作出治疗决定具有相关的临床意义,因为一些化合物ALK二级突变,如含L1198的化合物突变,似乎对下一代ALK-TKI具有抗性,但对环唑替尼敏感[42-43]。
在一个或多个第二代ALK TKI治疗失败的患者中,ctDNA中ALK突变的发生可能是预后相关的。尽管洛拉替尼在该亚组中报告了具有临床意义的疗效(RR为40%,PFS为6.9个月),但根据血浆基因分型,与突变阴性的患者相比,ctDNA中ALK突变阳性的患者报告洛拉替布的RR值更高(62%VS32%),PFS更长(7.3个月VS. 5.5个月)[15]。这些数据表明,ALK突变可辨别出使用第二代ALK TKI后具有持续ALK依赖性的肿瘤,并且缺失ALK突变也提示存在潜在的ALK非依赖性耐药机制的发生,使其不太可能对ALK抑制作出反应。然而,ALK突变阴性患者中也具有洛拉替尼疗效。以及在ctDNA中检测到的共突变的发生可能是相关的,例如高达50%的病例中的TP53突变与ALK-TKI治疗后较短的PFS相关[9,24-26]。因此,液体活检可以提供可能影响患者预后的共突变相关信息。最后,液体活检结果也可用于筛选对下一组ALK-TKI化疗中能获益更多的患者。
考虑到次级ALK耐药突变亚型对选择ALK-TKI的最佳顺序具有关键预后和预测价值,序列ctDNA分析可提供ALK-TKI治疗后致病分子进展的实时信息。这一信息可以指导临床医生的测序方法,而不是盲目的治疗决策。然而,采用定制方法对第二代ALK-TKI治疗后进展的患者预后的影响仍不清楚。两项正在进行的前瞻性研究,NCI-NRG ALK MASTER方案(NCT03737994)和EORTC-ALKALINE方案(NCT34127110),目前正在探索液体活检在该环境中的应用。
ALK独立于AR的机制也是有价值的,因为一些致病机制可以通过个性化调整策略来克服。比如NRG1和RET基因融合,以及EGFR或KRAS突变。此外,还发现了IDH1、NOTCH和NF1的突变[26]。他洛西替尼对基因融合有效,据报道,塞尔帕西替尼或普拉西替尼分别在NRG1和RET融合肿瘤中具有疗效[44-45]。在其他致癌上瘾性肿瘤中,如EGFR突变的NSCLC和RET介导的耐药,奥西莫替尼和普拉斯替尼的组合耐受性良好,并导致快速放射反应,这一结果与EGFR和RET-TKI的组合可能是克服AR机制的良好策略的观点相一致[46]。ALK肿瘤中这种治疗策略是否有用尚不清楚,但通过ctDNA检测RET融合是一种有效的筛选策略[47]。
在组织活检中,在下一代ALK-TKI复发患者的15%肿瘤活检中检测到MET扩增。值得注意的是,与仅用下一代ALK-TKI治疗的患者相比,先前用克唑替尼治疗后再使用下一代TKI的患者的肿瘤发生MET扩增的可能性显著降低(9% VS. 33%,P<0.019),因为克唑替尼具有抗MET活性[48-50],减少了这些患者中MET扩增的出现。在液体活检中,MET扩增频率为7%。尽管在组织活检中MET扩增与ALK抗性突变相互排斥,但在ctDNA分析中,半数具有局灶性MET扩增的样本被同时发现含有ALK突变和血浆中的MET扩增。这可能表明在不同的肿瘤部位发生不同的耐药机制使得肿瘤变得更加具有异质性。与EGFR突变肿瘤相似,ALK-TKI效价与产生ALK非依赖性耐药机制(如MET扩增)的可能性之间存在关联,在组织(22% VS. 12%)或液体活检(17% VS. 3%)中,洛拉替尼治疗后ALK-TKI的效价高于第二代ALK-TKI治疗后(图1)[28]。
先前的数据表明,预先给予第三代ALK-TKI可以预防靶向耐药突变的发生,有可能改善患者的临床结局[42],但预先使用下一代ALK-TKI可能会导致三分之一的病例出现MET驱动的耐药[28]。这确实是一个挑战,因为第二代ALK-TKI是对患者一线护理的新标准,MET扩增可能在多达三分之一的病例中成为获得性耐药的机制。目前的问题在于确定预测MET抑制剂敏感性的MET扩增的最佳阈值,以及确定双ALK和MET抑制剂的作用。且是否应该与抗MET-TKI、抗药物缀合物或具有MET抑制的抗体结合使用还仍不清楚。
结论
尽管获得性ALK突变仍然是下一代ALK-TKI后AR的主要机制,G1202R是半数病例中最常见的ALK突变,但高达三分之一以前未使用环唑替尼治疗的肿瘤发生MET扩增。RET融合是ALK阳性NSCLC中AR的另一种药物作用机制。所有这些机制都可以在液体活检中确定,从而增加了TKI进展时具有基因组肖像的患者的比例,这些患者可能受益于序贯定制治疗。新的治疗策略,主要是抗ALK和抗MET的双重组合,以及抗ALK与抗融合(RET、NRG1)是这类肺癌的未来挑战。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors (Jesús Corral, Laura Mezquita and Ernest Nadal) for the series “ALK and ROS-1 NSCLC Patients Treatment Approach Based on Genomic Profile by Liquid Biopsy” published in Precision Cancer Medicine. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at https://pcm.amegroups.com/article/view/10.21037/pcm-20-33/coif). The series “ALK and ROS-1 NSCLC Patients Treatment Approach Based on Genomic Profile by Liquid Biopsy” was commissioned by the editorial office without any funding or sponsorship. LELH. serves as an unpaid editorial board member of Precision Cancer Medicine from February 2021 to January 2023. LELH reports other from boehringer ingelheim, other from BMS, other from Roche Genentech, other from BMS, grants from Roche Genentech, grants from Boehringer Ingelheim, other from AstraZeneca, personal fees from Quadia, grants from Astra Zeneca, other from Eli Lilly, other from Roche Genentech, other from Pfizer, other from MSD, other from Takeda, non-financial support from AstraZeneca, non-financial support from Novartis, non-financial support from BMS, non-financial support from MSD/Merck, non-financial support from GSK, non-financial support from Takeda, non-financial support from Blueprint Medicines, non-financial support from Roche Genentech, outside the submitted work. JR reports other from MSD, other from BOEHRINGER, other from PFIZER, personal fees and other from OSE IMMUNOTHERAPEUTICS, other from BMS, other from ASTRAZENECA, other from ROCHE, outside the submitted work. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med 2014;371:2167-77. [Crossref] [PubMed]
- Solomon BJ, Kim DW, Wu YL, et al. Final Overall Survival Analysis From a Study Comparing First-Line Crizotinib Versus Chemotherapy in ALK-Mutation-Positive Non-Small-Cell Lung Cancer. J Clin Oncol 2018;36:2251-8. [Crossref] [PubMed]
- Wu YL, Lu S, Lu Y, et al. Results of PROFILE 1029, a Phase III Comparison of First-Line Crizotinib versus Chemotherapy in East Asian Patients with ALK-Positive Advanced Non-Small Cell Lung Cancer. J Thorac Oncol 2018;13:1539-48. [Crossref] [PubMed]
- Soria JC, Tan DSW, Chiari R, et al. First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer (ASCEND-4): a randomised, open-label, phase 3 study. Lancet 2017;389:917-29. [Crossref] [PubMed]
- Peters S, Camidge DR, Shaw AT, et al. Alectinib versus Crizotinib in Untreated ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2017;377:829-38. [Crossref] [PubMed]
- Mok T, Camidge DR, Gadgeel SM, et al. Updated overall survival and final progression-free survival data for patients with treatment-naive advanced ALK-positive non-small-cell lung cancer in the ALEX study. Ann Oncol 2020;31:1056-64. [Crossref] [PubMed]
- Camidge DR, Kim HR, Ahn MJ, et al. Brigatinib versus Crizotinib in ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2018;379:2027-39. [Crossref] [PubMed]
- Camidge R, Kim HR, Ahn MJ, et al. Brigatinib vs crizotinib in patients with ALK inhibitor-naive advanced ALK+ NSCLC: Updated results from the phase III ALTA-1L trial. Ann Oncol 2019;30:ix195-6. [Crossref]
- Gainor JF, Dardaei L, Yoda S, et al. Molecular Mechanisms of Resistance to First- and Second-Generation ALK Inhibitors in ALK-Rearranged Lung Cancer. Cancer Discov 2016;6:1118-33. [Crossref] [PubMed]
- Duruisseaux M, Besse B, Cadranel J, et al. Overall survival with crizotinib and next-generation ALK inhibitors in ALK-positive non-small-cell lung cancer (IFCT-1302 CLINALK): a French nationwide cohort retrospective study. Oncotarget 2017;8:21903-17. [Crossref] [PubMed]
- Pacheco JM, Gao D, Smith D, et al. Natural History and Factors Associated with Overall Survival in Stage IV ALK-Rearranged Non-Small Cell Lung Cancer. J Thorac Oncol 2019;14:691-700. [Crossref] [PubMed]
- Shaw AT, Kim TM, Crinò L, et al. Ceritinib versus chemotherapy in patients with ALK-rearranged non-small-cell lung cancer previously given chemotherapy and crizotinib (ASCEND-5): a randomised, controlled, open-label, phase 3 trial. Lancet Oncol 2017;18:874-86. [Crossref] [PubMed]
- Huber RM, Hansen KH, Paz-Ares Rodríguez L, et al. Brigatinib in Crizotinib-Refractory ALK+ NSCLC: 2-Year Follow-up on Systemic and Intracranial Outcomes in the Phase 2 ALTA Trial. J Thorac Oncol 2020;15:404-15. [Crossref] [PubMed]
- Novello S, Mazières J, Oh IJ, et al. Alectinib versus chemotherapy in crizotinib-pretreated anaplastic lymphoma kinase (ALK)-positive non-small-cell lung cancer: results from the phase III ALUR study. Ann Oncol 2018;29:1409-16. [Crossref] [PubMed]
- Shaw AT, Solomon BJ, Besse B, et al. ALK Resistance Mutations and Efficacy of Lorlatinib in Advanced Anaplastic Lymphoma Kinase-Positive Non-Small-Cell Lung Cancer. J Clin Oncol 2019;37:1370-9. [Crossref] [PubMed]
- Solomon BJ, Besse B, Bauer TM, et al. Lorlatinib in patients with ALK-positive non-small-cell lung cancer: results from a global phase 2 study. Lancet Oncol 2018;19:1654-67. [Crossref] [PubMed]
- Shaw AT, Kim DW, Mehra R, et al. Ceritinib in ALK-rearranged non-small-cell lung cancer. N Engl J Med 2014;370:1189-97. [Crossref] [PubMed]
- Gettinger SN, Zhang S, Hodgson JG, et al. Activity of brigatinib (BRG) in crizotinib (CRZ) resistant patients (pts) according to ALK mutation status. J Clin Oncol 2016;34:9060. [Crossref]
- Wolf J, Helland Å, Oh I, et al. Phase 3 ALUR Study of Alectinib in Pretreated ALK+ NSCLC: Final Efficacy, Safety and Targeted Genomic Sequencing Analyses. J Thorac Oncol 2019;14:S210. [Crossref]
- Remon J, Tabbò F, Jimenez B, et al. Sequential blinded treatment decisions in ALK-positive non-small cell lung cancers in the era of precision medicine. Clin Transl Oncol 2020;22:1425-9. [Crossref] [PubMed]
- Chouaid C, Dujon C, Do P, et al. Feasibility and clinical impact of re-biopsy in advanced non small-cell lung cancer: a prospective multicenter study in a real-world setting (GFPC study 12-01). Lung Cancer 2014;86:170-3. [Crossref] [PubMed]
- Gadgeel SM, Mok TSK, Peters S, et al. Phase II/III blood first assay screening trial (BFAST) in patients (pts) with treatment-naïve NSCLC: Initial results from the ALK+ cohort. Ann Oncol 2019;30:v918. [Crossref]
- Dagogo-Jack I, Brannon AR, Ferris LA, et al. Tracking the Evolution of Resistance to ALK Tyrosine Kinase Inhibitors through Longitudinal Analysis of Circulating Tumor DNA. JCO Precis Oncol 2018; [Crossref] [PubMed]
- Horn L, Whisenant JG, Wakelee H, et al. Monitoring Therapeutic Response and Resistance: Analysis of Circulating Tumor DNA in Patients With ALK+ Lung Cancer. J Thorac Oncol 2019;14:1901-11. [Crossref] [PubMed]
- Mezquita L, Swalduz A, Jovelet C, et al. Clinical Relevance of an Amplicon-Based Liquid Biopsy for Detecting ALK and ROS1 Fusion and Resistance Mutations in Patients With Non-Small-Cell Lung Cancer. JCO Precis Oncol 2020; [Crossref] [PubMed]
- McCoach CE, Blakely CM, Banks KC, et al. Clinical Utility of Cell-Free DNA for the Detection of ALK Fusions and Genomic Mechanisms of ALK Inhibitor Resistance in Non-Small Cell Lung Cancer. Clin Cancer Res 2018;24:2758-70. [Crossref] [PubMed]
- Dagogo-Jack I, Rooney M, Lin JJ, et al. Treatment with Next-Generation ALK Inhibitors Fuels Plasma ALK Mutation Diversity. Clin Cancer Res 2019;25:6662-70. [Crossref] [PubMed]
- Dagogo-Jack I, Yoda S, Lennerz JK, et al. MET Alterations Are a Recurring and Actionable Resistance Mechanism in ALK-Positive Lung Cancer. Clin Cancer Res 2020;26:2535-45. [Crossref] [PubMed]
- Ding M, Deng L, Yu R, et al. Case Report: Temporal Heterogeneity of ALK Activating Mutations in Sequential ALK TKI-Treated Non-Small-Cell Lung Cancer Revealed Using NGS-Based Liquid Biopsy. Clin Lung Cancer 2019;20:e229-32. [Crossref] [PubMed]
- Paweletz CP, Lau CJ, Oxnard GR. Does Testing Error Underlie Liquid Biopsy Discordance? JCO Precis Oncol 2019; [Crossref] [PubMed]
- Rolfo C, Mack PC, Scagliotti GV, et al. Liquid Biopsy for Advanced Non-Small Cell Lung Cancer (NSCLC): A Statement Paper from the IASLC. J Thorac Oncol 2018;13:1248-68. [Crossref] [PubMed]
- Johung KL, Yeh N, Desai NB, et al. Extended Survival and Prognostic Factors for Patients With ALK-Rearranged Non-Small-Cell Lung Cancer and Brain Metastasis. J Clin Oncol 2016;34:123-9. [Crossref] [PubMed]
- Aldea M, Hendriks L, Mezquita L, et al. Circulating Tumor DNA Analysis for Patients with Oncogene-Addicted NSCLC With Isolated Central Nervous System Progression. J Thorac Oncol 2020;15:383-91. [Crossref] [PubMed]
- Boire A, Brandsma D, Brastianos PK, et al. Liquid biopsy in central nervous system metastases: a RANO review and proposals for clinical applications. Neuro Oncol 2019;21:571-84. [Crossref] [PubMed]
- Seoane J, De Mattos-Arruda L, Le Rhun E, et al. Cerebrospinal fluid cell-free tumour DNA as a liquid biopsy for primary brain tumours and central nervous system metastases. Ann Oncol 2019;30:211-8. [Crossref] [PubMed]
- Gong J, Gregg JP, Ma W, et al. Squamous Cell Transformation of Primary Lung Adenocarcinoma in a Patient With EML4-ALK Fusion Variant 5 Refractory to ALK Inhibitors. J Natl Compr Canc Netw 2019;17:297-301. [Crossref] [PubMed]
- Park S, Han J, Sun JM. Histologic transformation of ALK-rearranged adenocarcinoma to squamous cell carcinoma after treatment with ALK inhibitor. Lung Cancer 2019;127:66-8. [Crossref] [PubMed]
- Levacq D, D'Haene N, de Wind R, et al. Histological transformation of ALK rearranged adenocarcinoma into small cell lung cancer: A new mechanism of resistance to ALK inhibitors. Lung Cancer 2016;102:38-41. [Crossref] [PubMed]
- Reckamp K, Lin HM, Huang J, et al. Comparative efficacy of brigatinib versus ceritinib and alectinib in patients with crizotinib-refractory anaplastic lymphoma kinase-positive non-small cell lung cancer. Curr Med Res Opin 2019;35:569-76. [Crossref] [PubMed]
- Bordi P, Tiseo M, Rofi E, et al. Detection of ALK and KRAS Mutations in Circulating Tumor DNA of Patients With Advanced ALK-Positive NSCLC With Disease Progression During Crizotinib Treatment. Clin Lung Cancer 2017;18:692-7. [Crossref] [PubMed]
- Lin JJ, Riely GJ, Shaw AT. Targeting ALK: Precision Medicine Takes on Drug Resistance. Cancer Discov 2017;7:137-55. [Crossref] [PubMed]
- Yoda S, Lin JJ, Lawrence MS, et al. Sequential ALK Inhibitors Can Select for Lorlatinib-Resistant Compound ALK Mutations in ALK-Positive Lung Cancer. Cancer Discov 2018;8:714-29. [Crossref] [PubMed]
- Shaw AT, Friboulet L, Leshchiner I, et al. Resensitization to Crizotinib by the Lorlatinib ALK Resistance Mutation L1198F. N Engl J Med 2016;374:54-61. [Crossref] [PubMed]
- Tirunagaru VG, Estrada-Bernal A, Yu H, et al. Abstract: Tarloxotinib exhibits potent activity in NRG1 fusion and rearranged cancers. AACR Annual Meeting 2019; March 29-April 3, 2019; Atlanta, GA.
- Subbiah V, Cote GJ. Advances in Targeting RET-Dependent Cancers. Cancer Discov 2020;10:498-505. [Crossref] [PubMed]
- Piotrowska Z, Isozaki H, Lennerz JK, et al. Landscape of Acquired Resistance to Osimertinib in EGFR-Mutant NSCLC and Clinical Validation of Combined EGFR and RET Inhibition with Osimertinib and BLU-667 for Acquired RET Fusion. Cancer Discov 2018;8:1529-39. [Crossref] [PubMed]
- Rich TA, Reckamp KL, Chae YK, et al. Analysis of Cell-Free DNA from 32,989 Advanced Cancers Reveals Novel Co-occurring Activating RET Alterations and Oncogenic Signaling Pathway Aberrations. Clin Cancer Res 2019;25:5832-42. [Crossref] [PubMed]
- Camidge D, Otterson G, Clark JW, et al. Crizotinib in patients (pts) with MET-amplified non-small cell lung cancer (NSCLC): Updated safety and efficacy findings from a phase 1 trial. J Clin Oncol 2018;36:9062. [Crossref]
- Landi L, Chiari R, Tiseo M, et al. Crizotinib in MET-Deregulated or ROS1-Rearranged Pretreated Non-Small Cell Lung Cancer (METROS): A Phase II, Prospective, Multicenter, Two-Arms Trial. Clin Cancer Res 2019;25:7312-9. [Crossref] [PubMed]
- Moro-Sibilot D, Cozic N, Pérol M, et al. Crizotinib in c-MET- or ROS1-positive NSCLC: results of the AcSé phase II trial. Ann Oncol 2019;30:1985-91. [Crossref] [PubMed]
唐楠
复旦大学附属肿瘤医院(更新时间:2023-05-05)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Remon J, Esteller L, Hendriks LEL. Mechanisms of resistance after crizotinib or second-generation ALK therapy in advanced non-small cell lung cancer. Precis Cancer Med 2022;5:4.