非小细胞肺癌ALK药物序贯治疗:一项病例报告
简介:“ALK序贯治疗NSCLC”
肺癌是最常见的癌症相关死亡原因之一,大多数患者在疾病的早期便发生转移[1],这些患者的治疗方式主要是系统性化疗。了解转移性非小细胞肺癌(non-small cell lung cancer,NSCLC)的分子通路可以提高对其的理解,以及促进开发针对相应亚型的特征性靶向药物[2]。
2%~7%的NSCLC患者被报道携带间变性淋巴瘤激酶(ALK)基因重排[3],其中最常见的是与棘皮动物微管相关蛋白样4(echinoderm microtubule-associated protein-like 4,EML4)的融合,该部分患者通常是不吸烟者或轻度吸烟的年轻患者,这也促进了针对这些患者特定治疗的发展,与其他标准治疗相比,携带ALK-EML4融合基因的NSCLC患者对ALK抑制剂的反应更好[4]。
第一个得到应用的ALK抑制剂是克唑替尼。先使用克唑替尼,后续使用ALK酪氨酸激酶抑制剂治疗的患者的总生存期(overall survival,OS)明显改善,并且安全性良好。在PROFILE 1014研究的最终分析中,仍未观察到患者的中位OS[5]。在其他研究中,研究者同样观察到先用ALK抑制剂,然后再用其他药物治疗的OS获益。在更新的ALEX研究中,克唑替尼组患者的中位OS为57.4个月,而艾乐替尼组未达到中位OS,这可能是由于使用了培美曲塞和其他ALK酪氨酸激酶抑制剂。通过分析真实世界数据(real-world data,RWD),我们发现了类似的结果,在第一次TKI进展使用其他TKI治疗的患者的中位OS为89.6个月,相比于在CLINALK研究中转移性患者的数据具有统计学差异,而GLASS研究的中位OS为90.3±24.4个月,在两个队列中(ALK+、ROS+患者)无统计学意义。
本文病例报告中的患者取得了明显的OS获益,而随着对基因组、耐药机制研究的不断深入,治疗顺序选择也变得更加重要。
案例展示
在这里,我们报告了一例具有13包/年吸烟史的52岁女性患者。2010年5月,她因咳嗽和呼吸困难接受了胸部RX、CT、PET-TC以及支气管镜检查,最终诊断为局部晚期肺腺癌(ⅢB期,右上叶肿块和同侧和隆突下淋巴结肿大)。本研究中,涉及患者的所有程序均符合机构和/或国家研究委员会的道德标准以及赫尔辛基宣言(2013年修订),并且取得患者的书面知情同意。
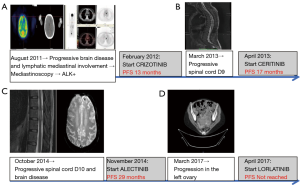
患者于2010年6月接受了以根治性同步放化疗(顺铂/紫杉醇和放疗,总剂量69.6 Gy)并取得了部分缓解,但在2010年10月观察到脑部进展(3个新结节位于左侧颞叶、左侧额叶和右胼胝体)。随后,她在脑病灶中接受了射波刀治疗,获得了充分缓解,并在后续进行了6个周期的卡铂/培美曲塞治疗和9个月的培美曲塞维持治疗。2011年8月,PET-CT发现新的淋巴纵隔受累和脑部疾病进展,随后进行了全脑放疗,纵隔镜检查提示ALK突变(图1A)。
患者于2012年2月开始使用克唑替尼,取得了13个月的部分缓解,并且耐受性良好。2013年3月,她因D9脊髓受压而出现进行性骨病(图1B),随后接受了放射治疗(20 Gy)并出现了残余截瘫。
患者于2013年4月至2014年9月加入ASCEND-5临床试验使用色瑞替尼治疗,但耐受性差且伴有3级肝毒性,其中经历两次色瑞替尼减量,获得了17个月的疾病稳定。
2014年10月,影像学提示出现了新的脑、骨病灶(图1C),患者开始使用艾乐替尼,疾病部分缓解并显示出良好的耐受性,未观察到明显毒性,在这种第二代ALK抑制剂的治疗下获得了29个月的无进展生存(progression-free survival,PFS)。
最后,在艾乐替尼治疗期间,2017年3月CT提示左侧卵巢和新的淋巴结转移病灶(图1D)。患者进行了根治性妇科手术,病理提示左卵巢病灶与肺腺癌病理一致,基于Foundation One平台二代测序(next-generation sequencing,NGS)检测到新的EML4-ALK(变异3a/b)G1202R位点突变。该患者肿瘤突变负荷较低(2 Mut/Mb),并且检测到MLL3 I4835Fs*4。此后,她开始使用劳拉替尼,目前耐受性良好,唯一的不良反应是偶尔的复视、高胆固醇血症和高甘油三酯血症,均可通过治疗得到很好的控制。
随着下一代ALK TKI药物的合理使用,该患者的OS已经超过10年。
本研究中,涉及患者的所有程序均符合机构和/或国家研究委员会的道德标准以及赫尔辛基宣言(2013年修订),并且取得患者对于出版病例报告和随附图像的书面知情同意,其副本可供本刊编辑部审阅。
讨论
对于所有Ⅳ期的NSCLC患者,均应评估相应的分子标志物,包括ALK基因重排,这种改变在年轻患者和非吸烟者中更常见。ALK易位可通过NGS、免疫组织化学(immunohistochemistry,IHC)、荧光原位杂交(fluorescence in situ hybridization,FISH)检测[6]。在转移性NSCLC中,ALK基因重排(ALK阳性)提示对ALK抑制剂的敏感性,是延长该类患者PFS的最佳选择[7],多项临床试验也提示了ALK抑制剂的优效性。
第一个相对化疗显示出有效性的ALK抑制剂是克唑替尼,并且在一线和后线治疗中都观察到相同的现象。在该病例报告中,患者在接受一线化疗时被诊断为ALK阳性肺腺癌,并在二线治疗中接受克唑替尼。PROFILE 1014研究提示克唑替尼优于化疗,其主要终点是PFS,经历17个月的随访后,克唑替尼的客观缓解率(objective response rate,ORR)高于化疗(74%VS45%),中位PFS延长(10.9个月VS7个月;HR=0.45)[8]。在比较第二代ALK抑制剂与化疗的ASCEND-4研究中,色瑞替尼的中位PFS为16.6个月,而化疗组为8.1个月,HR为0.45(95%CI:0.42~0.73,P<0.001),但两组的OS无统计学差异[9]。在ALEX研究中,患者被随机分配接受一线艾乐替尼和克唑替尼治疗,接受艾乐替尼的患者进展或死亡风险降低了53%(HR=0.47,95%CI:0.34~0.65),在进行更新10个月的随访后,艾乐替尼组的中位PFS为35个月,而克唑替尼组为11个月(HR=0.43),OS结果尚未成熟[10]。劳拉替尼是一种强大的第三代ALK TKI药物,已被批准用于治疗在接受艾乐替尼或、色瑞替尼或克唑替尼和至少一种其他ALK抑制剂一线治疗进展的ALK阳性NSCLC患者。因为劳拉替尼对所有已知的ALK抑制剂耐药突变都有活性,包括在该患者中检测到的G1202R,这也是目前艾乐替尼耐药情况下的首选药物[11]。这种突变导致对其他下一代ALK抑制剂,包括色瑞替尼、艾乐替尼和布加替尼等药物的耐药性[12]。FDA目前已经基于Ⅱ期研究(B7461001)的结果[13]批准了劳拉替尼的应用,其中劳拉替尼的ORR为47%(部分缓解45%,完全缓解2%),根据先前接受过的治疗进行分层的疗效如下:克唑替尼后,ORR=73%,中位PFS为11.1个月,中位缓解持续时间未达到;使用一种或多种第二代ALK抑制剂后,ORR=40%,中位PFS为6.9个月,中位反应持续时间7.1个月[14]。
PROFILE 1014研究的最终分析提示,中位随访时间为46个月时,化疗的中位OS为47.5个月,而克唑替尼未达到。克唑替尼在不同时间点的OS均高于化疗组(1年,83.5%VS78.4%;18个月,71.5%VS66.6%;4年,56.6%VS49.1%),风险比(hazard ratio,HR)0.346(95%CI:0.081~0.718),该治疗的中位OS为59.8个月(95%CI:46.6至未达到)和化疗19.2个月(95%CI:13.6至未达到)。克唑替尼能改善PFS,但对OS无明显影响,这可能是由于进展后使用了其他有效的治疗[5]。根据接受的后续方案,研究者对OS进行了亚组分析,发现在任何后续治疗方案中接受克唑替尼和至少一种ALK抑制剂的组中OS最长,目前未达到中位OS。我们的这项病例报告提示,该患者受益于一系列ALK抑制剂,OS超过59.8个月。在一项回顾性研究中,患者在一种或多种第二代TKI进展后接受铂类与培美曲塞治疗,提示ORR=29.7%,中位缓解持续时间为6.4个月[15]。
真实世界分析可以提示类似于临床试验的结果,法国CLINALK研究分析了接受克唑替尼的ALK阳性NSCLC患者,发现克唑替尼进展后,接受新一代ALK抑制剂的患者与接受除新一代ALK抑制剂或最佳支持治疗以外的后续药物相比OS更好:从诊断转移性疾病开始为89.6个月,疾病进展后中位生存期为25个月[16]。GLASS回顾性研究发现,ALK+患者使用劳拉替尼的疾病控制率为91%,ORR分别为60%(颅外疾病)和62%(颅内疾病),中位OS为90.3±24.4个月,没有统计学差异[17]。加拿大的另一项真实数据回顾性研究中,接受克唑替尼和艾乐替尼治疗的ALK+患者的中位PFS和OS分别为17个月和48.5个月[18]。
在NSCLC中,脑转移与预后不良相关,但在具有ALK突变的患者中,对这些治疗的反应优于没有ALK突变的患者。艾乐替尼和劳拉替尼在脑转移中提示更好的疗效,并且无论基线时是否存在中枢神经系统(central nervous system,CNS)转移,艾乐替尼均显示出优于克唑替尼的PFS获益。对于有基线CNS转移的患者,艾乐替尼的中位PFS(25.4个月;95%CI:9.2至未达到)高于克唑替尼(7.4个月;95%CI:6.6~9.6)。对于无基线CNS转移的患者,艾乐替尼组的中位PFS为38.6个月,克唑替尼组为14.8个月(HR=0.46,95%CI:0.31~0.68)。在该病例报告中,患者在基线和五线治疗时发现脑转移,使用艾乐替尼的PFS缓解时间为29个月,这比ALEX研究的报道更长。Ⅱ期研究(B7461001)根据是否有CNS转移对疾病进展的患者进行分组,在12个月时,接受克唑替尼作为首次治疗且无基线CNS转移的患者的累积发病率(cumulative incidence rate,CIR)高于伴CNS转移患者(分别为43%和9%),在伴有基线CNS转移的患者中,CIR相同(两组均为22%)。在接受过第二代ALK TKI药物治疗的患者中,在12个月时,无论是否伴有基线CNS转移,非CNS进展的CIR均高于CNS进展的CIR(35%VS23%和55%VS12%)[19-20]。
对于ALK阳性NSCLC患者,无论是否伴有基线CNS转移,在接受克唑替尼或第二代ALK TKI治疗进展后,劳拉替尼都具有颅内活性。该患者目前仍在接受劳拉替尼治疗,未达到疾病进展。最近,Crown临床试验的中期分析数据已经公布,这是一项针对ALK阳性转移性NSCLC患者的3期试验,比较一线使用劳拉替尼与克唑替尼的疗效,以劳拉替尼作为首选治疗的患者PFS和颅内反应更好,克唑替尼组的12个月PFS为39%(95%CI:30%~48%),劳拉替尼组为78%(95%CI:70%~84%),HR为0.28,P<0.001,并通过独立的中央审查。截止数据时,克唑替尼组的中位PFS为9.3个月,而劳拉替尼组未达到。在基线时CNS转移的患者中,劳拉替尼组的颅内反应更高,克唑替尼组为66%(95%CI:49%~80%),而克唑替尼组为20%(95%CI:9%~36%)。在CNS转移灶可测量的患者中,克唑替尼组的颅内反应为23%,而劳拉替尼组为82%。克唑替尼组的12个月颅内反应持续为0%,劳拉替尼组为72%,克唑替尼组和劳拉替尼组首次发生CNS转移的发生率分别为33%和3%,HR=0.06(95%CI:0.02~0.18)。最常见的不良事件是高胆固醇血症和高脂血症、周围神经病变、水肿和认知影响。这些数据使得其他临床试验有必要考虑将第二、三代ALK抑制剂应用至一线治疗[21−22]。
尽管目前艾乐替尼是这些患者的标准一线治疗,我们认为接受连续的ALK抑制剂可能改善OS,目前亟待新的诊断策略为患者提供最有效的治疗,克服对ALK抑制剂的耐药。循环肿瘤细胞(circulating tumor cell,CTC)测序可用于识别在对下一代ALK-TKI耐药的ALK重排NSCLC患者中的继发性耐药突变机制[23]。在接受第二代和第三代ALK TKI治疗的患者中,另一项研究使用NGS平台分析了血浆样本,随着每一代ALK TKI药物的应用,ALK耐药突变增加,并且其可能被肿瘤基因分型低估[24]。通过结合患者来源的模型与纵向的肿瘤组织样本有助于了解肿瘤动力学和疾病进展的生物学过程,这对我们确定使用下一代ALK-TKI治疗的最佳顺序非常重要[25]。
未来需要更深入地了解这类肿瘤的分子特征及其继发性耐药突变,以确定每位ALK重排NSCLC患者的最佳治疗方法,从而可以通过改善这些患者的生活质量和治疗耐受性来延迟化疗。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by Guest Editors (Jesús Corral, Laura Mezquita and Ernest Nadal) for the series “ALK and ROS-1 NSCLC Patients Treatment Approach Based on Genomic Profile by Liquid Biopsy” published in Precision Cancer Medicine. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at https://pcm.amegroups.com/article/view/10.21037/pcm-21-13/coif). The series “ALK and ROS-1 NSCLC Patients Treatment Approach Based on Genomic Profile by Liquid Biopsy” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: All authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved. All procedures performed in this study were in accordance with the ethical standards of the institutional and/or national research committee and with the Declaration of Helsinki (as revised in 2013). Written informed consent was obtained from the patient for publication of this case report and accompanying images. A copy of the written consent is available for review by the editorial office of this journal.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014. CA Cancer J Clin 2014;64:9-29. [Crossref] [PubMed]
- Pikor LA, Ramnarine VR, Lam S, et al. Genetic alterations defining NSCLC subtypes and their therapeutic implications. Lung Cancer 2013;82:179-89. [Crossref] [PubMed]
- Soda M, Choi YL, Enomoto M, et al. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer. Nature 2007;448:561-6. [Crossref] [PubMed]
- Kwak EL, Bang YJ, Camidge DR, et al. Anaplastic lymphoma kinase inhibition in non-small-cell lung cancer. N Engl J Med 2010;363:1693-703. [Crossref] [PubMed]
- Solomon BJ, Kim DW, Wu YL, et al. Final Overall Survival Analysis From a Study Comparing First-Line Crizotinib Versus Chemotherapy in ALK-Mutation-Positive Non-Small-Cell Lung Cancer. J Clin Oncol 2018;36:2251-8. [Crossref] [PubMed]
- Lin C, Shi X, Yang S, et al. Comparison of ALK detection by FISH, IHC and NGS to predict benefit from crizotinib in advanced non-small-cell lung cancer. Lung Cancer 2019;131:62-8. [Crossref] [PubMed]
- Koivunen JP, Mermel C, Zejnullahu K, et al. EML4-ALK fusion gene and efficacy of an ALK kinase inhibitor in lung cancer. Clin Cancer Res 2008;14:4275-83. [Crossref] [PubMed]
- Solomon BJ, Mok T, Kim DW, et al. First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med 2014;371:2167-77. [Crossref] [PubMed]
- Soria JC, Tan DSW, Chiari R, et al. First-line ceritinib versus platinum-based chemotherapy in advanced ALK-rearranged non-small-cell lung cancer (ASCEND-4): a randomised, open-label, phase 3 study. Lancet 2017;389:917-29. Erratum in: Lancet 2017;389:908. [Crossref] [PubMed]
- Peters S, Camidge DR, Shaw AT, et al. Alectinib versus Crizotinib in Untreated ALK-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2017;377:829-38. [Crossref] [PubMed]
- Camidge DR, Dziadziuszko R, Peters S, et al. Updated Efficacy and Safety Data and Impact of the EML4-ALK Fusion Variant on the Efficacy of Alectinib in Untreated ALK-Positive Advanced Non-Small Cell Lung Cancer in the Global Phase III ALEX Study. J Thorac Oncol 2019;14:1233-43. [Crossref] [PubMed]
- Baglivo S, Ricciuti B, Ludovini V, et al. Dramatic Response to Lorlatinib in a Heavily Pretreated Lung Adenocarcinoma Patient Harboring G1202R Mutation and a Synchronous Novel R1192P ALK Point Mutation. J Thorac Oncol 2018;13:e145-7. [Crossref] [PubMed]
- Gainor JF, Dardaei L, Yoda S, et al. Molecular Mechanisms of Resistance to First- and Second-Generation ALK Inhibitors in ALK-Rearranged Lung Cancer. Cancer Discov 2016;6:1118-33. [Crossref] [PubMed]
- Solomon BJ, Besse B, Bauer TM, et al. Lorlatinib in patients with ALK-positive non-small-cell lung cancer: results from a global phase 2 study. Lancet Oncol 2018;19:1654-67. [Crossref] [PubMed]
- Lin JJ, Schoenfeld AJ, Zhu VW, et al. Efficacy of Platinum/Pemetrexed Combination Chemotherapy in ALK-Positive NSCLC Refractory to Second-Generation ALK Inhibitors. J Thorac Oncol 2020;15:258-65. [Crossref] [PubMed]
- Duruisseaux M, Besse B, Cadranel J, et al. Overall survival with crizotinib and next-generation ALK inhibitors in ALK-positive non-small-cell lung cancer (IFCT-1302 CLINALK): a French nationwide cohort retrospective study. Oncotarget 2017;8:21903-17. [Crossref] [PubMed]
- Peled N, Gillis R, Kilick S, et al. GLASS: Global Lorlatinib for ALK(+) and ROS1(+) retrospective Study: real world data of 123 NSCLC patients. Lung Cancer 2020;148:48-54. [Crossref] [PubMed]
- Gibson AJW, Box A, Dean ML, et al. Retrospective Real-World Outcomes for Patients With ALK-Rearranged Lung Cancer Receiving ALK Receptor Tyrosine Kinase Inhibitors. JTO Clin Res Rep 021;2:100157.
- Mok T, Camidge DR, Gadgeel SM, et al. Updated overall survival and final progression-free survival data for patients with treatment-naive advanced ALK-positive non-small-cell lung cancer in the ALEX study. Ann Oncol 2020;31:1056-64. [Crossref] [PubMed]
- Bauer TM, Shaw AT, Johnson ML, et al. Brain Penetration of Lorlatinib: Cumulative Incidences of CNS and Non-CNS Progression with Lorlatinib in Patients with Previously Treated ALK-Positive Non-Small-Cell Lung Cancer. Target Oncol 2020;15:55-65. [Crossref] [PubMed]
- Shaw AT, Solomon BJ, Besse B, et al. ALK Resistance Mutations and Efficacy of Lorlatinib in Advanced Anaplastic Lymphoma Kinase-Positive Non-Small-Cell Lung Cancer. J Clin Oncol 2019;37:1370-9. [Crossref] [PubMed]
- Shaw AT, Bauer TM, de Marinis F, et al. First-Line Lorlatinib or Crizotinib in Advanced ALK-Positive Lung Cancer. N Engl J Med 2020;383:2018-29. [Crossref] [PubMed]
- Pailler E, Faugeroux V, Oulhen M, et al. Acquired Resistance Mutations to ALK Inhibitors Identified by Single Circulating Tumor Cell Sequencing in ALK-Rearranged Non-Small-Cell Lung Cancer. Clin Cancer Res 2019;25:6671-82. [Crossref] [PubMed]
- Dagogo-Jack I, Rooney M, Lin JJ, et al. Treatment with Next-Generation ALK Inhibitors Fuels Plasma ALK Mutation Diversity. Clin Cancer Res 2019;25:6662-70. [Crossref] [PubMed]
- Recondo G, Mezquita L, Facchinetti F, et al. Diverse Resistance Mechanisms to the Third-Generation ALK Inhibitor Lorlatinib in ALK-Rearranged Lung Cancer. Clin Cancer Res 2020;26:242-55. [Crossref] [PubMed]
吴松阳
复旦大学附属肿瘤医院(更新时间:2023-05-05)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Miriam AG, Amparo SG, Reyes BC, Cristina BPJ, Irene CG. ALK non-small cell lung cancer sequence of treatment: a case report. Precis Cancer Med 2022;5:8.