
放射治疗在三阴性乳腺癌中的作用:现状和未来方向——叙述性综述
介绍
三阴性乳腺癌(TNBC)占所有浸润性乳腺癌的10%~20%。它由多个分子亚型组成,目前关于某些亚型的信息有限。TNBC经常与年轻、BRCA1突变、侵袭性形态学特征(肿瘤坏死、高有丝分裂指数、高分级)和较差的结果相关,而这些结果并不总是与传统的预后特征相关,如分期、肿瘤大小或淋巴结累及[2-3]。然而,尽管缺乏药物靶向受体,总体预后较差,但对这一肿瘤亚型缺乏特定的治疗策略,因此TNBC采用传统治疗方法,对TNBC的局部治疗建议总体上与其他侵袭性乳腺癌亚型相似。因此,这类患者在治疗中可能会带来挑战,特别是因为我们对这种亚型的理解仍处于初级阶段。因此,为了改善TNBC的治疗结果,有必要了解驱动攻击行为的潜在生物学因素,以便采取更个性化的治疗策略。
在此,本文综述了放疗在晚期TNBC中的作用。首先,我们将总结TNBC的复发时间和复发模式及其对局部治疗的影响;其次是总结根据手术步骤进行放疗和新辅助化疗在这一具有挑战性的乳腺癌亚组中的作用;最后是讨论未来的方向和新的治疗策略。生物因素及其对辐射反应的影响在其他地方进行了讨论,因此在本文中没有进行讨论[4]。我们按照《叙事评论》报告清单提交这篇文章(可点击https://pcm.amegroups.com/article/view/10.21037/pcm-21-9/rc获取)[5]。
搜索策略和数据源
利用医学主题词(MeSH)和与“乳腺癌”“放疗”“三重阴性”相关的文本词,检索了PubMed和Medline(OVID)电子数据库从2009年至2020年6月的数据。摘要被审查和适当的全文检索。这项研究得到了作者个人和机构专业知识的补充。
TNBC复发的时间和模式
乳腺癌复发的时间和模式因亚型而异。
复发时间
TNBC在诊断后早期复发,复发的中位时间在1.6~3年之间[1,6-7]。Dent等人研究了1601例乳腺癌患者,其中180例为三阴性TN[1]。研究表明,在中位随访8.1年后,TNBC患者在确诊5年内远端复发和死亡的风险高于非TNBC患者,后者的HR分别为2.6(2.0~3.5)和3.2(2.3~4.5)。TNBC患者的远处复发风险在3年后达到峰值,然后迅速下降,而非TNBC患者的风险不变。TNBC到局部复发的平均时间(2.8年)比非TNBC(4.2年)短,但两组的局部复发率相似(分别为13%和12%;P=0.77)。此外,Pogoda等人回顾了2534例患者,其中228例患有TNBC。中位随访6年后,35%的患者出现疾病复发。发生局部复发、脑和/或肺转移的风险在2年后最高,此后显著下降。骨和肝转移的风险在2~3年后达到高峰,但仅略有下降,5年后仍可见骨转移事件[8]。
局部区域复发部位
TNBC和非TNBC患者的局部区域性失败部位不同。与非TNBC患者相比,TNBC患者的淋巴结复发与乳腺/胸壁复发更为常见[9-11]。Wu等人在1088例患者(其中146例患有TNBC)的队列中显示,非TNBC患者中80%和20%的局部复发分别位于乳腺/胸壁和区域淋巴结,而TNBC患者的50%局部复发为淋巴结[9]。Noh等人在一个有105例TNBC的596例患者的队列中报告了类似的模式:乳腺和胸壁复发在非TNBC患者中更常见,而淋巴结复发(尤其是锁骨上)主要见于TNBC[10]。同样,Haffty等人表明,在一个有482例患者和117例TNBC的队列中,TNBC与更差的淋巴结无复发率和原因特异性生存率相关[11]。
远处失败发生率和失败部位也因乳腺癌亚型而异。TNBC比非TNBC更容易显示远处复发[1,9,11-12]。Steward等人在对414例TNBC患者的回顾中显示,26.6%的患者在中位随访68.2个月后出现复发。孤立性远处复发率达到16.9%,另有5%的病例出现远处和局部混合复发[12]。Dent等人表明,与非TNBC患者相比,TNBC患者发生远处复发的比例更高(分别为33.9%和20.4%;P<0.0001)[1]。Haffty等人还表明,TNBC患者的无远处转移率(68%)在统计学上低于非TNBC患者[11],而Wu等人表明,在TNBC患者中远处转移率最高(27.4%)[9]。
远距离复发
乳腺癌远处复发的发生率和部位也因表型而异。与其他亚型相比,TNBC患者的内脏转移多倾向于骨转移[6,9,13]。Lin等人报告了321例TNBC患者中位随访3.15年后,局部、内脏和骨复发率分别为15.79%、4.67%和3.74%[7]。后续研究包括2569名TNBC患者(15204例患者中)的结果表明,TNBC患者经历了更多的脑、内脏和骨骼复发,与非TNBC相比,肺和局部复发以及作为首次复发的骨复发较少,风险比(HR)分别为3.5(2.1~5.85)、2.17(1.47~3.21)、1.32(1.01~1.74)和0.26(0.19~0.36)[13]。虽然文献中似乎一致报道脑和肺复发,但一些研究未能显示骨和肝转移因亚型而异。Noh等人表明,TNBC患者的脑复发率更高(28.6%),但亚型之间的其他转移部位相同[10]。Wu等人还表明,亚型之间的骨转移具有可比性[9]。
总之,现有证据表明TNBC患者有明显的复发模式。他们表现为早期复发,主要是腋窝和锁骨上区域的局部淋巴结复发。因此,应考虑在TNBC的治疗管理中使用局部照射。此外,与非TNBC相比,远处复发也值得关注,它们在2~3年达到峰值,主要在大脑和肺部。之后,复发风险逐渐消失,而骨复发甚至在5年后仍继续发生。在TNBC患者的系统治疗和随访时间表中,应考虑这些信息。
放射治疗在外科手术中的作用
在出现关于TNBC的侵袭性及其局部复发风险较高的数据后,建议对该亚型患者进行乳房保护引起了一些关注。然而,多个研究观察了TNBC和非TNBC患者辅助放疗保乳后的结果。这些研究根据亚型报告了局部复发(LRR)和生存结果。表1总结了仅报告保守治疗的乳腺癌患者的选定研究数据。他们表明,这类患者的LRR率非常低,大多数患者在五年内的LRR低于10%[14-16]。Haffty等人报告了两种亚型患者(TNBC和非TNBC)5年后的高复发率,约为17%,但研究纳入的时间框架非常大[11]。虽然Haffty等人和Freedman等人在不同亚型之间的LRR没有差异,但Nguyen等人和Solin等人确实表明TNBC的局部复发率是非TNBC患者的两倍以上,但绝对数字低于10%。幸运的是,这些结果并没有转化为生存差异。大多数研究显示,无论亚型如何,5年的总生存期(OS)相同。其他研究比较了采用保乳治疗(BCT)或乳腺切除术治疗的TNBC患者的结果。Abdulkarim等人报告了768例接受BCT、乳房切除术或乳房切除术和PMRT治疗的TNBC患者。在86.4个月的中位随访(FU)后,他们发现BCT患者的LRR为6%,而乳房切除术患者的LRR为15%(P<0.001),HR为3.44(2.05~5.8)。总生存期也有利于BCT,其值为87% VS. 82%(P<0.001)。当仅观察T1−2N0患者时,他们报告BCT组的LRR显著降低(4% VS. 10%,P=0.022),但OS无差异[17]。Lowery等人和Zumsteg等人发表的研究表明,BCT与乳房切除术的LRR结果相同,而Adkins等人的BCT复发率显著降低[18-20]。在O'Rorke等人于2016年发表的一项荟萃分析中,比较BCT与单纯乳房切除术的研究表明,在1795例患者中,BCT与单独乳房切除术相比,LRR为0.61(0.41~0.9)的HR具有优势,BCT的OS优势为0.56(0.36~0.88)[21]。当仅考虑早期疾病(T1−2N0)时,LRR的HR仍然显著,HR为0.55(0.32~0.95),OS的HR为0.74(0.43~1.29)时无差异。这些数据表明,辅助放疗保乳是TNBC完全可接受的选择,因为局部复发率低,而且与其他亚型或单独乳房切除术的存活率相同。
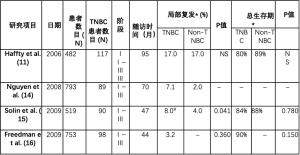
Full table
我想到的下一个问题是,某些患者是否可以完全跳过辅助放射治疗。这项研究针对老年患者,尤其是激素受体阳性患者。对于这一类患者,随机试验表明,即使局部复发率略高,省略辅助放射治疗也不会影响生存率[22-23]。关于TNBC患者这一问题的数据很少,报告了两项观察研究;第一项研究是Eaton等人发表的SEER登记研究。2016年,该研究分析了3432例激素受体阴性并进行了保守治疗的老年患者。接受辅助放射治疗的患者在5年时乳腺癌特异性死亡的累积发生率为10.8%,而未接受辅助放射疗法的患者为24.1%(P<0.0001)。本研究中未报告局部复发,但乳房切除术的需要可能是复发的良好替代。报告了该结果,并显示5年后乳房切除术的累积发生率在统计学上较高,4.9% VS. 8.3%省略辅助放疗[24]。第二项研究不仅特别关注激素受体阴性患者,而且特别关注70岁以上保守治疗的TNBC患者,这是一项对8526例T1−2N0M0 TNBC患者的国家癌症数据库回顾。中位FU为38个月后,显示接受辅助放射治疗的患者组的5年OS高于单纯手术组的55.3%(P<0.001),约为77.2%。在年龄、分期和化疗使用分层后,这种效应持续存在[25]。
最后一点要讨论的是,与单纯乳房切除术相比,乳房切除术后增加放射治疗的价值。关于这个问题,几乎没有发表任何证据。Kyndi等人[26]发表的早期丹麦文献数据显示,PMRT显著降低TNBC患者的LRR(P<0.01),但并未改善OS。事实上,在该研究中PMRT仅与激素受体阳性组的OS改善相关。Abdulkarim等人在TNBC中加入PMRT后,LRR降低(15%VS13%)[17]。Wang等人还展示,添加PMRT后复发率较低(25.4%VS11.7%,P=0.02),OS也有利于PMRT,单独乳房切除术组为78.7%,而PMRT组为90.4%(P=0.03)[27]。另一方面,Haque等人发表的国家癌症数据库的最新分析表明,淋巴结阴性疾病(T1−4N0)的TNBC患者在乳房切除术后增加放疗与整个组OS的显著改善无关(HR为0.88,95%CI:0.75~1.03)。就OS而言,只有T3N0患者明显受益于PMRT[28]。由于年轻患者可能从PMRT中获益更多。本研究受其观察性和年轻患者数量少(33%与wang研究中的60%相比)的限制,国家癌症数据库(NCDB)登记处也没有LRR数据。
总之,尽管PMRT对于晚期疾病的TNBC患者可能有价值,但没有可靠的数据可以保证在早期T1−2N0患者乳房切除术后系统使用放射治疗,可以建议选择具有多种高危因素(如年轻或高等级)的患者。另一方面,T3N0患者可能受益于在标准化疗中添加PMRT。
新辅助全身治疗(NAT)后的放射治疗
在过去几年中,NAT治疗乳腺癌的适应证一直在扩大。NAT最初用于较大的肿瘤,以缩小肿瘤获得最佳的乳房保护,后来用于至少患有T2N0乳腺癌、Her2+和TNBC的患者,以评估疾病对全身治疗的反应并优化辅助治疗。然而,这种方法开启了对这些患者适当使用放射治疗及其价值的讨论。目前的指南并没有专门针对特定乳腺癌亚型的放射治疗适应证。在本次审查的范围内,即关于TNBC的管理,我们审查了指南和可用数据,试图确定一般指南是否适用于TNBC。
美国乳腺外科医生协会于2015年发布了NAT后乳腺癌患者管理指南[29]。他们建议在乳房保护的背景下系统地使用放射治疗。乳房切除术后,他们建议根据初始临床病理阶段使用放射治疗,而不考虑NAT的反应。美国放射肿瘤学学会还发布了关于NAT环境下乳房切除术后放射治疗使用指南的建议,他们支持对未能实现完全切除的患者使用乳房切除后放射治疗(PMRT)节点响应。然而,对于对NAT反应良好的患者,由于缺乏一致的数据,无法就停止PMRT提出明确建议[30]。需要进一步的试验来解决这一特殊问题。
很少有研究根据NAT中的乳腺癌亚型研究局部区域复发(LRR)的风险,在表2中进行了总结。报告结果表明,三阴性乳腺癌(TNBC)患者亚组的LRR风险较高,在一些研究中可能达到25%[33],而NAT后的总体LRR率相对较低(范围为2.2%~11%)[31-32,34-41]。在所有报告的研究中,TNBC表型与LRR的关联并不一致。在大多数可用研究中,TNBC表型被报告为LRR的独立预测因子,报告的相对风险(RR)介于2.72和8.5之间[31,34-36,38-40]。然而,Cho等人和Vargo等人并未发现TNBC和LRR之间存在任何关联[32,41]。在NAT的设置中,应考虑传统上与LRR相关的其他高风险因素,这些因素包括年轻[RR1.35(1.16~1.57)][31]、晚期临床阶段cT3T4[RR5(2.5~10.1)][34]、高级别疾病[RR介于1.33和6.93之间][31,36]、未能实现病理完全缓解(pCR)[31,39]、临床阳性腋窝淋巴结[RR1.47(1.29~1.71)][31]和腋窝淋巴结达不到完全反应(阳性残余淋巴结的RR9.8,无论其数量如何,多于四个残余淋巴结为2.9)[35,39]。Chen等人提出,NAT后残留腋窝淋巴结是TNBC患者LRR的独立预测因子,RR为10.23(3.19~32.78)[33]。
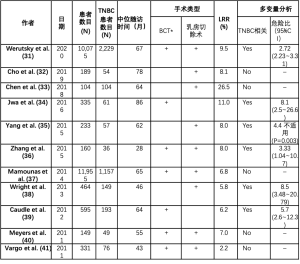
Full table
总之,根据现有证据,强烈建议在BCT后和残留阳性淋巴结患者的乳房切除术后,在NAT环境下对TNBC患者使用放射治疗。在出现阴性病理性腋窝时,应大力考虑放射治疗,特别是如果存在其他高危特征,如年轻(<50岁)、高阶段或高级别。
未来的方向和新的治疗策略
由于迄今为止缺乏已知的治疗靶点,靶向治疗的发展在TNBC的背景下一直具有挑战性。因此,控制免疫系统是一种有吸引力的策略,特别是考虑到TNBC是乳腺癌亚型中最具免疫原性的假设[42]。早期侵袭性TNBC患者肿瘤中肿瘤浸润淋巴细胞(TIL)的存在与预后改善相关[43]。免疫检查点抑制剂已在TNBC患者的晚期和早期疾病中产生了有希望的结果,并有望显著改善TNBC的整体预后[44]。在TNBC的临床管理中,特别令人感兴趣的是使用辐射来增强对免疫治疗的反应。辐射增加了肿瘤的突变负荷,优化了抗原呈递,并可减少肿瘤微环境中的免疫抑制因子,从而启动肿瘤进行免疫治疗[45]。这增强了肿瘤免疫原性并增加了肿瘤部位效应免疫细胞的存在。对原发性乳腺肿瘤进行局部辐射与CTLA−4阻断和PD−1\/PD−L1阻断相结合,在临床前小鼠模型中显示出协同活性[46]。放射治疗的特征是“免疫调节”,并被认为是通过诱导能够产生体内免疫效果的促炎细胞因子发出“危险”信号,能够产生体内接种效果[47]。RT和免疫治疗关联的另一个潜在益处涉及大量证据,表明RT可以对辐射场外的肿瘤细胞产生抑制作用[48]。
因此,放射疗法(剂量、分级、体积)与免疫疗法的适当组合在理论上具有局部和系统的高度有效性。临床前数据显示,与SBRT组分的最大RT−免疫治疗相互作用,如6~8 Gy,分1~3次进行[49]。许多正在进行的临床研究将RT和免疫疗法结合在转移性肿瘤中,即TNBC中,所有的研究都是早期阶段,并测试了该关联的耐受性,在局部和远程控制方面进行了几项测试,以寻找一种abscopal效应。采用免疫刺激性RT或不采用免疫刺激性RT的免疫疗法的时机似乎很重要,因为肿瘤负荷越小,这些治疗的效率就越高。因此,理想的RT免疫治疗研究应设计在早期或低转移情况下。
另一方面,过去曾使用过术前乳房放射治疗(RT),但较早的研究未能改变实践。回顾性研究表明,RT作为唯一的术前治疗是有效的,尤其是在pCR记录为26%患者的三阴性乳腺癌中[50]。最近人们对使用现代技术和新的RT药物组合重新审视术前RT很感兴趣[51]。与医学肿瘤学、外科学以及基础和转化研究的多学科合作对于该方法的最终成功至关重要。
总之,应鼓励TNBC患者参与临床试验,因为围绕这一侵袭性乳腺癌亚型的治疗仍有许多未解之谜。未来的研究方向应集中于免疫治疗和放射治疗的结合,特别是在低转移和低进展TNBC的情况下。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor (Jacques Raphael) for the series “Management of Triple Negative Breast Cancer” published in Precision Cancer Medicine. The article has undergone external peer review.
Reporting Checklist: The authors have completed the Narrative Review reporting checklist. Available at: https://pcm.amegroups.com/article/view/10.21037/pcm-21-9/rc
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at: https://pcm.amegroups.com/article/view/10.21037/pcm-21-9/coif). The series “Management of Triple Negative Breast Cancer” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects for the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Dent R, Trudeau M, Pritchard KI, et al. Triple-negative breast cancer: clinical features and patterns of recurrence. Clin Cancer Res 2007;13:4429-34. [Crossref] [PubMed]
- Bauer KR, Brown M, Cress RD, et al. Descriptive analysis of estrogen receptor (ER)-negative, progesterone receptor (PR)-negative, and HER2-negative invasive breast cancer, the so-called triple-negative phenotype: a population-based study from the California cancer Registry. Cancer 2007;109:1721-8. [Crossref] [PubMed]
- Carey LA, Perou CM, Livasy CA, et al. Race, breast cancer subtypes, and survival in the Carolina Breast Cancer Study. JAMA 2006;295:2492-502. [Crossref] [PubMed]
- Moran MS. Radiation therapy in the locoregional treatment of triple-negative breast cancer. Lancet Oncol 2015;16:e113-22. [Crossref] [PubMed]
- Green BN, Johnson CD, Adams A. Writing narrative literature reviews for peer-reviewed journals: secrets of the trade. J Chiropr Med 2006;5:101-17. [Crossref] [PubMed]
- Königsberg R, Pfeiler G, Klement T, et al. Tumor characteristics and recurrence patterns in triple negative breast cancer: a comparison between younger (<65) and elderly (≥65) patients. Eur J Cancer 2012;48:2962-8. [Crossref] [PubMed]
- Lin Y, Yin W, Yan T, et al. Site-specific relapse pattern of the triple negative tumors in Chinese breast cancer patients. BMC Cancer 2009;9:342. [Crossref] [PubMed]
- Pogoda K, Niwiiwi T, Zhou L, et al. Site-specific relapse pattern of the triple negative tumors in Chinese breast cative breast cancer patients. Med Oncol Northwood Lond Engl 2013;30:388. [Crossref]
- Wu X, Baig A, Kasymjanova G, et al. Pattern of Local Recurrence and Distant Metastasis in Breast Cancer By Molecular Subtype. Cureus 2016;8:e924. [Crossref] [PubMed]
- Noh JM, Choi DH, Huh SJ, et al. Patterns of recurrence after breast-conserving treatment for early stage breast cancer by molecular subtype. J Breast Cancer 2011;14:46-51. [Crossref] [PubMed]
- Haffty BG, Yang Q, Reiss M, et al. Locoregional relapse and distant metastasis in conservatively managed triple negative early-stage breast cancer. J Clin Oncol 2006;24:5652-7. [Crossref] [PubMed]
- Steward L, Conant L, Gao F, et al. Predictive factors and patterns of recurrence in patients with triple negative breast cancer. Ann Surg Oncol 2014;21:2165-71. [Crossref] [PubMed]
- Lin NU, Vanderplas A, Hughes ME, et al. Clinicopathologic features, patterns of recurrence, and survival among women with triple-negative breast cancer in the National Comprehensive Cancer Network. Cancer 2012;118:5463-72. [Crossref] [PubMed]
- Nguyen PL, Taghian AG, Katz MS, et al. Breast cancer subtype approximated by estrogen receptor, progesterone receptor, and HER-2 is associated with local and distant recurrence after breast-conserving therapy. J Clin Oncol 2008;26:2373-8. [Crossref] [PubMed]
- Solin LJ, Hwang WT, Vapiwala N. Outcome after breast conservation treatment with radiation for women with triple-negative early-stage invasive breast carcinoma. Clin Breast Cancer 2009;9:96-100. [Crossref] [PubMed]
- Freedman GM, Anderson PR, Li T, et al. Locoregional recurrence of triple-negative breast cancer after breast-conserving surgery and radiation. Cancer 2009;115:946-51. [Crossref] [PubMed]
- Abdulkarim BS, Cuartero J, Hanson J, et al. Increased risk of locoregional recurrence for women with T1-2N0 triple-negative breast cancer treated with modified radical mastectomy without adjuvant radiation therapy compared with breast-conserving therapy. J Clin Oncol 2011;29:2852-8. [Crossref] [PubMed]
- Adkins FC, Gonzalez-Angulo AM, Lei X, et al. Triple-negative breast cancer is not a contraindication for breast conservation. Ann Surg Oncol 2011;18:3164-73. [Crossref] [PubMed]
- Lowery AJ, Kell MR, Glynn RW, et al. Locoregional recurrence after breast cancer surgery: a systematic review by receptor phenotype. Breast Cancer Res Treat 2012;133:831-41. [Crossref] [PubMed]
- Zumsteg ZS, Morrow M, Arnold B, et al. Breast-conserving therapy achieves locoregional outcomes comparable to mastectomy in women with T1-2N0 triple-negative breast cancer. Ann Surg Oncol 2013;20:3469-76. [Crossref] [PubMed]
- O'Rorke MA, Murray LJ, Brand JS, et al. The value of adjuvant radiotherapy on survival and recurrence in triple-negative breast cancer: A systematic review and meta-analysis of 5507 patients. Cancer Treat Rev 2016;47:12-21. [Crossref] [PubMed]
- Kunkler IH, Williams LJ, Jack WJ, et al. Breast-conserving surgery with or without irradiation in women aged 65 years or older with early breast cancer (PRIME II): a randomised controlled trial. Lancet Oncol 2015;16:266-73. [Crossref] [PubMed]
- Hughes KS, Schnaper LA, Bellon JR, et al. Lumpectomy plus tamoxifen with or without irradiation in women age 70 years or older with early breast cancer: long-term follow-up of CALGB 9343. J Clin Oncol 2013;31:2382-7. [Crossref] [PubMed]
- Eaton BR, Jiang R, Torres MA, et al. Benefit of adjuvant radiotherapy after breast-conserving therapy among elderly women with T1-T2N0 estrogen receptor-negative breast cancer. Cancer 2016;122:3059-68. [Crossref] [PubMed]
- Haque W, Verma V, Hsiao KY, et al. Omission of radiation therapy following breast conservation in older (≥70 years) women with T1-2N0 triple-negative breast cancer. Breast J 2019;25:1126-33. [Crossref] [PubMed]
- Kyndi M, Sørensen FB, Knudsen H, et al. Estrogen receptor, progesterone receptor, HER-2, and response to postmastectomy radiotherapy in high-risk breast cancer: the Danish Breast Cancer Cooperative Group. J Clin Oncol 2008;26:1419-26. [Crossref] [PubMed]
- Wang J, Shi M, Ling R, et al. Adjuvant chemotherapy and radiotherapy in triple-negative breast carcinoma: a prospective randomized controlled multi-center trial. Radiother Oncol 2011;100:200-4. [Crossref] [PubMed]
- Haque W, Verma V, Farach A, et al. Postmastectomy radiation therapy for triple negative, node-negative breast cancer. Radiother Oncol 2019;132:48-54. [Crossref] [PubMed]
- Holmes D, Colfry A, Czerniecki B, et al. Performance and Practice Guideline for the Use of Neoadjuvant Systemic Therapy in the Management of Breast Cancer. Ann Surg Oncol 2015;22:3184-90. [Crossref] [PubMed]
- Recht A, Comen EA, Fine RE, et al. Postmastectomy Radiotherapy: An American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology Focused Guideline Update. Pract Radiat Oncol 2016;6:e219-34. [Crossref] [PubMed]
- Werutsky G, Untch M, Hanusch C, et al. Locoregional recurrence risk after neoadjuvant chemotherapy: A pooled analysis of nine prospective neoadjuvant breast cancer trials. Eur J Cancer 2020;130:92-101. [Crossref] [PubMed]
- Cho WK, Park W, Choi DH, et al. The Benefit of Post-Mastectomy Radiotherapy in ypN0 Patients after Neoadjuvant Chemotherapy According to Molecular Subtypes. J Breast Cancer 2019;22:285-96. [Crossref] [PubMed]
- Chen X, Xia F, Luo J, et al. Postmastectomy radiotherapy reduces locoregional and disease recurrence in patients with stage II-III triple-negative breast cancer treated with neoadjuvant chemotherapy and mastectomy. Onco Targets Ther 2018;11:1973-80. [Crossref] [PubMed]
- Jwa E, Shin KH, Kim JY, et al. Locoregional Recurrence by Tumor Biology in Breast Cancer Patients after Preoperative Chemotherapy and Breast Conservation Treatment. Cancer Res Treat 2016;48:1363-72. [Crossref] [PubMed]
- Yang TJ, Morrow M, Modi S, et al. The Effect of Molecular Subtype and Residual Disease on Locoregional Recurrence in Breast Cancer Patients Treated with Neoadjuvant Chemotherapy and Postmastectomy Radiation. Ann Surg Oncol 2015;22:S495-501. [Crossref] [PubMed]
- Zhang C, Wang S, Israel HP, et al. Higher locoregional recurrence rate for triple-negative breast cancer following neoadjuvant chemotherapy, surgery and radiotherapy. Springerplus 2015;4:386. [Crossref] [PubMed]
- Mamounas EP, Cortazar P, Zhang L, et al. Locoregional recurrence (LRR) after neoadjuvant chemotherapy (NAC): Pooled-analysis results from the Collaborative Trials in Neoadjuvant Breast Cancer (CTNeoBC). J Clin Oncol 2014;32:61. [Crossref]
- Wright JL, Takita C, Reis IM, et al. Predictors of locoregional outcome in patients receiving neoadjuvant therapy and postmastectomy radiation. Cancer 2013;119:16-25. [Crossref] [PubMed]
- Caudle AS, Yu TK, Tucker SL, et al. Local-regional control according to surrogate markers of breast cancer subtypes and response to neoadjuvant chemotherapy in breast cancer patients undergoing breast conserving therapy. Breast Cancer Res 2012;14:R83. [Crossref] [PubMed]
- Meyers MO, Klauber-Demore N, Ollila DW, et al. Impact of breast cancer molecular subtypes on locoregional recurrence in patients treated with neoadjuvant chemotherapy for locally advanced breast cancer. Ann Surg Oncol 2011;18:2851-7. [Crossref] [PubMed]
- Vargo JA, Beriwal S, Ahrendt GM, et al. Molecular class as a predictor of locoregional and distant recurrence in the neoadjuvant setting for breast cancer. Oncology 2011;80:341-9. [Crossref] [PubMed]
- Liu Z, Li M, Jiang Z, et al. A Comprehensive Immunologic Portrait of Triple-Negative Breast Cancer. Transl Oncol 2018;11:311-29. [Crossref] [PubMed]
- Loi S, Sirtaine N, Piette F, et al. Prognostic and predictive value of tumor-infiltrating lymphocytes in a phase III randomized adjuvant breast cancer trial in node-positive breast cancer comparing the addition of docetaxel to doxorubicin with doxorubicin-based chemotherapy: BIG 02-98. J Clin Oncol 2013;31:860-7. [Crossref] [PubMed]
- Borcherding N, Kolb R, Gullicksrud J, et al. Keeping Tumors in Check: A Mechanistic Review of Clinical Response and Resistance to Immune Checkpoint Blockade in Cancer. J Mol Biol 2018;430:2014-29. [Crossref] [PubMed]
- Demaria S, Bhardwaj N, McBride WH, et al. Combining radiotherapy and immunotherapy: a revived partnership. Int J Radiat Oncol Biol Phys 2005;63:655-66. [Crossref] [PubMed]
- Gong J, Le TQ, Massarelli E, et al. Radiation therapy and PD-1/PD-L1 blockade: the clinical development of an evolving anticancer combination. J Immunother Cancer 2018;6:46. [Crossref] [PubMed]
- Hallahan DE, Spriggs DR, Beckett MA, et al. Increased tumor necrosis factor alpha mRNA after cellular exposure to ionizing radiation. Proc Natl Acad Sci U S A 1989;86:10104-7. [Crossref] [PubMed]
- Formenti SC, Demaria S. Systemic effects of local radiotherapy. Lancet Oncol 2009;10:718-26. [Crossref] [PubMed]
- Herrera FG, Bourhis J, Coukos G. Radiotherapy combination opportunities leveraging immunity for the next oncology practice. CA Cancer J Clin 2017;67:65-85. [Crossref] [PubMed]
- Riet FG, Fayard F, Arriagada R, et al. Preoperative radiotherapy in breast cancer patients: 32 years of follow-up. Eur J Cancer 2017;76:45-51. [Crossref] [PubMed]
- Jang NY, Kim DH, Cho BJ, et al. Radiosensitization with combined use of olaparib and PI-103 in triple-negative breast cancer. BMC Cancer 2015;15:89. [Crossref] [PubMed]
李婉君
复旦大学附属肿瘤医院(更新时间:2023-05-05)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Azoury F, Misra S, Barry A, Helou J. Role of radiation therapy in triple negative breast cancer: current state and future directions—a narrative review. Precis Cancer Med 2022;5:3.

