
定义精准细胞免疫治疗——寻找生物标志物来预测和优化T细胞治疗癌症的结果
前言
过继细胞免疫治疗始于20世纪80年代,临床使用淋巴细胞因子激活的杀伤细胞、肿瘤浸润淋巴细胞(TILs)和其他过继T细胞来对抗癌症[1]。其科学和临床根源来自骨髓移植领域,移植物抗白血病效应实际上是一种异原性抗肿瘤免疫反应。
随后的几十年里,主要研发出肿瘤特异性TILs和转基因T细胞受体治疗(GM-TCR)用于实体肿瘤,但是其临床疗效有限[2-4]。病毒特异性细胞毒性T淋巴细胞(CTLs)输注在病毒相关恶性肿瘤中也取得临床疗效,包括移植后淋巴细胞增生性疾病、EB病毒(EBV)、乙型肝炎病毒和人乳头瘤病毒(HPV)相关癌症[5-8]。
然而,直到21世纪,在嵌合抗原受体T细胞(CAR-T)治疗难治性血液系统恶性肿瘤的成功引领下,T细胞疗法在癌症治疗中的真正潜力才得以发挥[9-11]。继2017年连续多项临床试验获得阳性结果,同时两项具有里程碑意义的适应症由美国食品药品管理局(FDA)快速审批通过后,CAR-T最近再次被美国临床肿瘤学会(ASCO)评为2018年“年度进展”。
T细胞治疗的研究进展
基因工程CAR包含抗原识别单链可变片段(scFv)、铰链区、跨膜区和可以激活淋巴细胞细胞毒功能的信号结构域。新一代CAR-T细胞还包含共刺激内域,可在体内更好地实现增殖和存活。目前,CD19 CAR-T细胞疗法已用于治疗各种复发性B细胞恶性肿瘤,包括弥漫大B细胞淋巴瘤(DLBCL)[9],B型急性淋巴细胞白血病(B-ALL)[10],慢性淋巴细胞白血病(CLL)[11]以及多发性骨髓瘤(MM)[12],其完全缓解率为30%~90%。
尽管CD19 CAR-T在儿童B-ALL中疗效显著,但急性CD19阴性白血病导致复发,由此促进研究出靶向CD22和CD19/CD22双靶CAR-T以改善疾病控制率[13]。大量其他CAR-T细胞靶点正在开发中,包括CD20、CD30、CD38、CD44、BCMA、CD123、CD138和CD171[14-17]。此外,也在努力加快供体来源(自体)和通用(同种异体)“现成”CAR-T的研发。目前有超过100个CAR-T试验正在进行中——据此需要更深入地研究生物标志物,以便更好地预测这些新疗法的获益可能[17]。
不幸的是,CAR-T在血液系统恶性肿瘤中取得的突破尚未在实体肿瘤中重现。尽管既往有报道CAR-T治疗结肠癌、肾癌、卵巢癌、肉瘤和中枢神经系统(CNS)肿瘤[18-21]的病例,但通常伴随显著的毒性和致死亡风险。人们还在努力设计新的治疗性归巢CAR-T细胞,以实现在免疫抑制肿瘤微环境(TME)中更好的传输和存活。一些临床试验也已获得阳性结果——在研究GD2特异性CAR-T细胞治疗儿童神经母细胞瘤的I期临床试验中,11例活动性疾病患者中有3例达到完全缓解[20]。一例伴有脊柱转移的复发性胶质母细胞瘤患者,通过脑室内途径和肿瘤实质局部应用IL13Rα2 CAR-T,获得了持久且显著的临床缓解[21]。
其他潜在治疗靶点,例如HER2、PMSA、CEA、EGFR、间皮素、MUC1和PSM[22-28]并非肿瘤细胞独有,并且可能导致非特异性靶向毒性:一名接受HER2 CAR-T治疗的结直肠癌患者因细胞因子释放综合征(CRS)而死亡。相比之下,另一项涉及HER2 CAR-T治疗肉瘤的试验并未报道类似并发症[24],说明尽管治疗靶点相同,但临床反应存在多变性。
除CAR-T疗法外,针对实体器官肿瘤的细胞治疗研究,其主要领域包括自体TILs输注和GM-TCR细胞治疗。TILs和GM-TCR细胞疗法的优势是它们能够识别细胞内抗原,而CAR-Ts只能结合表面抗原。针对多种体细胞肿瘤抗原(MART-1、gp100、p53、NY-ESO-1、MAGE-A3、MAGE-A4等)的GM-TCRs已被编辑至T细胞中,但在癌症中各不相同。效应性TILs更多是通过体外培养并使用肿瘤抗原体进行脉冲式刺激或与抗原呈递细胞共培养来进行预分选。既往肿瘤抗原是通过消化裂解肿瘤得到的,但通过更先进的测序和新抗原预测技术,可以制造设计出能更有效地刺激TILs的抗原。
事实上,过继回输靶向体细胞突变基因编码蛋白的淋巴细胞,已经能够使实体器官肿瘤患者获得临床缓解。最近,Rosenberg博士的T细胞治疗研究取得了突破性进展,一名化疗难治性转移性乳腺癌患者在接受体细胞突变特异性TILs治疗后,完全缓解时间已超过22个月[30]。
对于病毒相关肿瘤,过继回输体外活化和扩增的、靶向病毒抗原的自体T细胞,也展现出潜力。对EBV阳性鼻咽癌(NPC)患者进行EBV特异性T细胞输注,取得了较好的临床疗效和生存获益,且患者没有或很少出现短期或长期毒性[6,31]。针对HPV相关恶性肿瘤(例如宫颈癌)的类似疗法正在研发中。靶向肿瘤相关病毒抗原也更具技术优势。病毒蛋白靶点被认为比非病毒抗原更具有免疫源性,因此将T细胞扩增到输注患者所需的规模,难度较小。
在过继淋巴细胞疗法的发展过程中,主要挑战之一在于区分和识别潜在反应者和无反应者(NRs)。一部分接受CAR-T治疗的患者可能会出现危及生命的不良反应,包括CRS、巨噬细胞激活综合征、肿瘤溶解综合征、肝脏毒性甚至神经毒性[17,32-35]。过继细胞治疗的疗效不稳定、治疗成本高以及生产时间仍是其广泛应用的障碍。因此,当务之急是寻找能够提高过继T淋巴细胞疗效的预测性生物标志物。
生物标志物的定义
术语“生物标志物”可以宽泛地定义为:与患者总生存期和疾病进程相关的预后标志物,与治疗反应或毒性相关的预测标志物,甚至是治疗靶点。预后标志物也可以是预测标志物或者上述组合。乳腺癌中HER2的高表达,同时是预测性、预后性和治疗性生物标志物。
作为理想且广泛适用的生物标志物应该简单、易于获取并且可靠。为了确定预测性生物标志物,理想情况是应该在临床试验背景下,通过定量治疗方案与生物标志物交互关系(treatment-by-biomarker interaction)来比较患者的治疗效果[36]。然而,在某些情况下,临床前和早期临床数据提供令人信服的证据,是因为临床试验只在富集了特异性预测性生物标志物的人群中进行。
生物标志物可源自:(I)临床数据(例如人口统计学、治疗数据、临床参数);(II)基于血清(例如细胞因子和基线血液检测);(III)基于组织[例如肿瘤或免疫细胞的免疫组化(IHC)];(IV)基于基因组[例如全外显子测序(WES)、聚合酶链反应(PCR)];(V)其他特殊试验,如流式细胞术、酶联免疫吸附实验(ELISA)、以及功能实验等。
免疫检查点抑制剂的生物标志物
细胞毒性化疗和小分子药物生物标志物的研究主要集中在宿主特征和治疗对靶组织的影响上。有别于细胞免疫疗法中生物标志物的发现和应用刚刚起步,在过去十年中,ICIs中预测性生物标志物的定义越来越明确[37]。
ICI应用最广泛的生物标志物是PD-L1表达、肿瘤比例评分(TPS)、联合阳性评分(CPS)或者其他综合免疫评分[38]。其他ICI生物标志物包括血清中性粒细胞与淋巴细胞比率(NLR)、肿瘤突变负荷(TMB)、微卫星不稳定性(MSI)和错配修复蛋白缺陷(dMMR),其通常与新抗原负荷以及对ICIs的反应相关[37,38]。其他新兴的ICIs生物标志物包括其他基因组学实验(包括RNA测序)、细胞因子分析、外周循环免疫细胞、TCR多样性/库、HLA状态,甚至肠道微生物组学。最终,经过验证的cancer immunogram(肿瘤免疫相关权重)可能最能代表一组可以预测ICIs最佳疗效的独特特征[39]。成像技术尤其是多重免疫荧光的使用,也越来越有助于阐明TME以及其内部的免疫状态。
过继T细胞疗法的生物标志物
过继细胞疗法与传统药物的不同之处在于,该制品是一种“活的”生物实体,其治疗效果需要功能性和特异性免疫细胞,这些细胞在输注后可能在体内呈指数增长。因此,细胞疗法需要开发额外的生物标志物来描述复杂细胞产物的生物学特性——包括表型和功能特性。正如Kalos等人所总结的[40],细胞治疗参数可以大致描述为:(I)T细胞存在;(II)T细胞表型或功能能力;(III)对患者生物学(生物活性)的系统影响;(IV)患者对输注制品的免疫反应。
表1总结了这些广泛适用的评价指标,将生物标志物的类别区分为宿主特性和细胞制品特征。我们注意到,由于有限的研究以及细胞制品的异质性,很难为T细胞疗法找出统一的预测性生物标志物。在本篇综述中,我们将针对血液系统恶性肿瘤(表2)和实体肿瘤(表3)中的过继T细胞治疗,对已经评估和报道的阳性预测性生物标志物进行讨论。

Full table
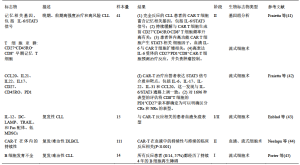
Full table

Full table
在研究axicabtagene ciloleucel治疗复发性DLBCL的Ⅱ期ZUMA-1试验中,观察到CAR-T在患者体内持续存在,患者反应更持久(3例患者达到24个月),体内扩增与治疗反应显著相关[44],为NRs的5.4倍。另外,在CAR-T治疗复发性CLL的Ⅰ期研究中,持续性B细胞再生障碍与治疗反应相关[45]。这些发现表明,尽管不是优先的“预测性标志物”,但在体内持续检测到CAR-T与治疗效果和不良反应相关。
目前为止,用于CAR-T疗效预测生物标志物仍然很少。不同时间点治疗中的细胞因子谱——在淋巴耗竭化疗和输注CARTs之前/之后——已被详细描述,并与临床结果相关[55]。虽然这些标志物在临床上可用于监测,但通常仅反映出宿主对治疗的免疫反应性,目前在指导是否使用CAR-T方面价值有限。
CRS和其他反映细胞免疫治疗毒性的生物标志物(细胞因子谱和血清实验室标志物)也有报道。输注前标志物(例如铁蛋白、CRP)和输注后细胞因子(例如IL-6、IFNγ和可溶性p130)的升高,通常与CRS相关,并有助于临床医生预测治疗失效节点[17,31,33,56]。
尽管CAR-T治疗B-ALL的有效率令人印象深刻,但另一方面,CLL患者中达到完全缓解(CRs)的仍是少数。宾夕法尼亚大学的CAR-T研究组最近报道了41例复发性CLL患者CD19 CAR-T的表型、功能和基因组特征[41,42]。他们没有发现预测CAR-T反应的宿主或疾病相关因素;CLL中CAR-T的治疗反应与患者年龄、既往治疗、遗传风险因素、疾病负荷、细胞剂量或其他临床特征(包括TMB)无关。因此,我们将重点关注T细胞制品和修饰前T细胞特征,尝试找到更能获益于CAR-T的人群。
上述研究的一个重要发现是鉴定出一个与更好临床结果相关的早期免疫记忆CAR-T细胞亚群。CR患者的CAR-T细胞中富含记忆相关基因,包括IL-6和STAT3相关信号(IL-6、IL-7、IL-22、IL-31和CCL20)。NRs T细胞的末端效应器分化、糖酵解、耗竭和凋亡基因表达上调,尤其是PD1、LAG3和TIM3(耗竭标志物)的表达。除转录组研究外,患者的功能性T细胞产生STAT3相关细胞因子,血清IL-6与CAR T细胞扩增相关。此外,持续缓解与CD27+CD45RO-CD8+淋巴细胞频率升高有关,这些细胞也具有记忆样特征[41,42]。通过流式细胞术对1696种表型进行检测分析,发现CD8+T细胞(具有高水平IL-6R)的一个PD1+CD27+亲本细胞群,其能将CR和NR患者明显区分开来——这可能是一个可以驱动治疗反应的相关细胞群。这些发现有助于CAR-Ts在未来发展中进行微调,并可以在CAR-T产生之前根据有利的宿主淋巴细胞表型改善临床决策。
在另一项研究CAR-T和CLL的I/II期临床试验中[43],应用CAR-T细胞治疗前,血浆免疫刺激标志物(包括IL-12、DC-LAMP、TRAIL和Fas配体)的水平升高与更长的总体生存期相关。相反,CAR输注后可溶性PDL1(sPDL1,P=0.023)和PDL2(sPDL2,P=0.002)的水平升高,与生存较差相关;IL-6(P=0.03)、IL-8(P=0.03)、和NAP3(P-0.04)水平升高也是如此。有治疗反应的患者,体内单核细胞骨髓源性抑制细胞(MDSCs),即CD14+CD33+HLA-DR-细胞,水平也较低。
据报道,在黑色素瘤患者初始队列中(n=13),过继免疫治疗后输注TILs的存在和持续增殖与临床客观有效率相关(P=0.002)[52]。另一项研究也得出类似结论:输注制品中TILs数量较高与临床有效反应相关(n=31)[51]。然而,其他研究并未发现宿主体内TILs的持续存在与临床之间存在显著相关性[50]。
Forget等人最近发表的一项临床试验[50],72例患者接受了TILs输注,总体有效率为42%,其中一些患者此前接受过ICIs(抗CTLA-4和抗PD1治疗)。IL-9的血清基线水平似乎可以预测患者对TILs的反应性。从功能上讲,IL-9在CD4+辅助T细胞的成熟过程中起关键作用,并且能够增加Th17应答。然而,Th17 T细胞的作用尚不完全清楚并且存在相互矛盾之处,因为它既有抗肿瘤功能,又有促炎功能。同样有趣的是,在输注3个月后,患者体内血清ULBP-9及其配体NKG2D水平升高。在同一项研究中,没有以宿主体内TILs持续存在、TMB和体外自体肿瘤识别等临床因素对患者预后进行分层研究。在宿主特征方面,之前接受过抗CTLA-4治疗和较短输注TILs的患者,治疗反应持续时间较短。
另一项利用自体TILs输注治疗转移性黑色素瘤患者的研究中(n=48)[46],Chen等人最初注意到,原始肿瘤中的CD8阳性IHC染色与这些患者最终扩增TILs产物中CD8+T细胞含量相关。他们还发现,与TIL非输注者相比,TIL输注者瘤内CD8、CD4和CD3的IHC染色更高。虽然CD8、PD-1和FoxP3染色不能预测肿瘤反应,但有人建议肿瘤周围和总CD4染色可以作为CR和部分反应(PR)的阴性预测因子(P=0.0067和P=0.082)。一年后,该研究组指出,肿瘤中CD8β、CD3δ、CD45RA、ICOS、PD-1和STAT4基因表达,以及细胞产物中TCR Vβ基因的水平升高,预测了TIL的良好扩增[47]。这些结果表明,有可能采用这些标记作为指导性生物标志物,来选择TILs较多的且有利于扩增的转移位点,以期获得更好的疗效。
在T细胞表型方面,Inozume等人发现在产生反应性TILs的肿瘤消化物中,CD8+PD1+TILs的百分比更高[48]。除PD1外,还发现一些其他T细胞标志物在预测治疗反应方面具有临床相关性。Ye等人发现,在黑色素瘤和卵巢癌细胞系中表达CD137(一种共刺激受体和T细胞活化标志物)的T细胞肿瘤反应性更高[49]。Radvanyi等人报道,CD8+BTLA+T细胞百分比、尤其是CD8+BTLA+效应T细胞百分比更高的TILs制品与转移性黑色素瘤治疗反应改善相关[51]。Forget等人进一步强调,虽然在CTLA-4 ICI初治患者中这个结论是正确的,但在难治性黑色素瘤患者中并不是这样。
Lamers等人在2013年[18]、Klaver等人在2016年[54]分别对一项早期研究的结果和潜在预测性生物标志物进行了报道,该研究包含12例接受碳酸酐酶IX(CAIX)CAR-T治疗的患者。在这项研究中没有临床治疗反应,直至输注前使用单克隆抗体(抗CAIX),最初可以观察到一些肝毒性2-4级的病例。患者血液中的CAR-T细胞数量与IFN-γ和IL-6的血浆水平相关,与其他检测的细胞因子无关[54]。因此,在检测的27种细胞因子中,作者认为血浆中IFN-γ和IL-6水平是CAR T细胞持续存在的潜在标志物。
单核细胞MDSCs通常与临床结果较差有关,它们通常与促进癌症进展的免疫抑制和逃逸机制相关。在我们中心完成了一项II期试验,35例4期NPC患者在一线方案吉西他滨和卡铂化疗后,接受了6个周期的自体EBV特异性CTLs过继治疗[6]。为了确定治疗结果的生物标志物,我们进行了多项深度免疫表型分析,包括流式细胞术、NanoString技术和多重ELISA检测。中位生存期较短的患者在化疗后,MDSCs和与MDSCs相关的细胞因子(例如IL-10和CCL22)水平较高。在MDSCs的短暂爆发之后,循环中活化的调节性T细胞(Tregs)持续增加。相反,在这些接受CTLs治疗的晚期NPC患者中,血清IFNγ水平与长期生存相关[53]。
在最近报道的一项研究HPV相关上皮癌病毒特异性TILs Ⅱ期试验中,Stevanović等人发现,与NRs相比,在用HPV E6和E7肽刺激后,CD137+T细胞和IFNγ产物含量更高的输注前TILs与应答者相关[8]。这与Ye等人的上述发现相呼应[49],强调了CD137在T细胞活化中的重要性。
结论
提高CAR-T疗法的疗效取决于前瞻性的特定治疗靶点的识别以及随后新一代CAR(包括合并共刺激蛋白)的开发,以改善CAR-T功能并规避不利的微环境,对于实体肿瘤治而言尤其如此。对于病毒特异性T细胞、TILs和GM-TCR细胞疗法,反应的主要预测因素之一仍然是肿瘤(或癌病毒)抗原TCR库的特异性。目标特征很重要——因为选择更好的TCRs或CARs,实现抗原活化,杀伤肿瘤的机会就越高。
然而,即使有越来越多的特异性TCRs或CARs,仍有许多变量可能影响细胞疗法的临床效果。由于这种“活体治疗”的复杂性,识别T细胞疗法的预测性生物标志物非常具有挑战性。患者的免疫适应性和细胞疗法的整体疗效,还有宿主免疫反应的流动性以及细胞疗法的相互作用,有许多决定因素。此外,在不同研究平台,一些实验结果是互相矛盾的。TIL表达共刺激(CD137)或共抑制(PD1、BTLA)信号预测肿瘤反应[49]。相反,在NRs的CAR-Ts中发现了PD-1、LAG3和TIM3耗竭标志物[41,42]。这个例子强调了细胞制品的异质性,应开发个体化生物标志物。
ICI治疗中一系列有效和潜在生物标志物的快速发展为寻找可靠的T细胞治疗预测和预后生物标志物带来了希望。
在过去的几十年里,预测细胞毒性化疗反应的生物标志物很少,甚至在后者中致癌成瘾之外的靶向治疗标志物也很少。由于目前此类疗法成本高昂,且需要找到有潜在治疗反应的患者,研究细胞治疗预测性生物标志物的作用仍然是一个新兴领域。
Acknowledgments
Funding: None.
Footnote
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/pcm.2019.07.02). WWW reports personal fees from Tessa Therapeutics Ltd., Singapore, outside the submitted work. HCT serves as an unpaid editorial board member of Precision Cancer Medicine from Jul 2018 to Jun 2020 and held the appointment of Chief Medical Officer at Tessa Therapeutics Ltd (now consultant) but there is no conflict of interest at all with this review article. The other authors have no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Rosenberg SA, Packard BS, Aebersold PM, et al. Use of tumor-infiltrating lymphocytes and interleukin-2 in the immunotherapy of patients with metastatic melanoma. A preliminary report. N Engl J Med 1988;319:1676-80. [Crossref] [PubMed]
- Johnson LA, Morgan RA, Dudley ME, et al. Gene therapy with human and mouse T-cell receptors mediates cancer regression and targets normal tissues expressing cognate antigen. Blood 2009;114:535-46. [Crossref] [PubMed]
- Rapoport AP, Stadtmauer EA, Binder-Scholl GK, et al. NY-ESO-1-specific TCR-engineered T cells mediate sustained antigen-specific antitumor effects in myeloma. Nat Med 2015;21:914-21. [Crossref] [PubMed]
- Morgan RA, Chinnasamy N, Abate-Daga D, et al. Cancer regression and neurological toxicity following anti-MAGE-A3 TCR gene therapy. J Immunother 2013;36:133-51. [Crossref] [PubMed]
- Haque T, Wilkie GM, Jones MM, et al. Allogeneic cytotoxic T-cell therapy for EBV-positive posttransplantation lymphoproliferative disease: results of a phase 2 multicenter clinical trial. Blood 2007;110:1123-31. [Crossref] [PubMed]
- Chia WK, Teo M, Wang WW, et al. Adoptive T-cell transfer and chemotherapy in the first-line treatment of metastatic and/or locally recurrent nasopharyngeal carcinoma. Mol Ther 2014;22:132-9. [Crossref] [PubMed]
- Johnson LA, June CH. Driving gene-engineered T cell immunotherapy of cancer. Cell Res 2017;27:38-58. [Crossref] [PubMed]
- Stevanović S, Draper LM, Langhan MM, et al. Complete regression of metastatic cervical cancer after treatment with human papillomavirus-targeted tumor-infiltrating T cells. J Clin Oncol 2015;33:1543-50. [Crossref] [PubMed]
- Schuster SJ, Bishop MR, Tam CS, et al. Tisagenlecleucel in adult relapsed or refractory diffuse large B-cell lymphoma. N Engl J Med 2019;380:45-56. [Crossref] [PubMed]
- Maude SL, Laetsch TW, Buechner J, et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. N Engl J Med 2018;378:439-48. [Crossref] [PubMed]
- Turtle CJ, Hay KA, Hanafi LA, et al. Durable molecular remissions in chronic lymphocytic leukemia treated with CD19-specific chimeric antigen receptor-modified T cells after failure of ibrutinib. J Clin Oncol 2017;35:3010-20. [Crossref] [PubMed]
- Garfall AL, Stadtmauer EA, June CH. Chimeric antigen receptor T cells in myeloma. N Engl J Med 2016;374:194. [PubMed]
- Zhao J, Song Y, Liu D. Clinical trials of dual-target CAR T cells, donor-derived CAR T cells, and universal CAR T cells for acute lymphoid leukemia. J Hematol Oncol 2019;12:17. [Crossref] [PubMed]
- Smith BD, Roboz GJ, Walter RB, et al. First-in man, phase 1 study of CSL362 (anti-IL3Rα/anti-CD123 monoclonal antibody) in patients with CD123+ acute myeloid leukemia (AML) in CR at high risk for early relapse. Blood. 2014;124:120.
- Casucci M, Nicolis di Robilant B, Falcone L, et al. CD44v6-targeted T cells mediate potent antitumor effects against acute myeloid leukemia and multiple myeloma. Blood 2013;122:3461-72. [Crossref] [PubMed]
- Fan F, Zhao W, Liu J, et al. Durable remissions with BCMA-specific chimeric antigen receptor (CAR)-modified T cells in patients with refractory/relapsed multiple myeloma. J Clin Oncol 2017;35:LBA3001. [Crossref]
- Townsend MH, Shrestha G, Robison RA, O'Neill KL. The expansion of targetable biomarkers for CAR T cell therapy. J Exp Clin Cancer Res 2018;37:163. [Crossref] [PubMed]
- Lamers CH, Sleijfer S, Vulto AG, et al. Treatment of metastatic renal cell carcinoma with autologous T-lymphocytes genetically retargeted against carbonic anhydrase IX: first clinical experience. J Clin Oncol 2006;24:e20-2. [Crossref] [PubMed]
- Kershaw MH, Westwood JA, Parker LL, et al. A phase I study on adoptive immunotherapy using gene-modified T cells for ovarian cancer. Clin Cancer Res 2006;12:6106-15. [Crossref] [PubMed]
- Louis CU, Savoldo B, Dotti G, et al. Antitumor activity and long-term fate of chimeric antigen receptor-positive T cells in patients with neuroblastoma. Blood 2011;118:6050-6. [Crossref] [PubMed]
- Brown CE, Alizadeh D, Starr R, et al. Regression of glioblastoma after chimeric antigen receptor T-cell therapy. N Engl J Med 2016;375:2561-9. [Crossref] [PubMed]
- Morgan RA, Yang JC, Kitano M, et al. Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2. Mol Ther 2010;18:843-51. [Crossref] [PubMed]
- Thistlethwaite FC, Gilham DE, Guest RD, et al. The clinical efficacy of first-generation carcinoembryonic antigen (CEACAM5)-specific CAR T cells is limited by poor persistence and transient pre-conditioning-dependent respiratory toxicity. Cancer Immunol Immunother 2017;66:1425-36. [Crossref] [PubMed]
- Ahmed N, Brawley VS, Hegde M, et al. Human epidermal growth factor receptor 2 (HER2)-specific chimeric antigen receptor-modified T cells for the immunotherapy of HER2-positive sarcoma. J Clin Oncol 2015;33:1688-96. [Crossref] [PubMed]
- Adusumilli PS, Cherkassky L, Villena-Vargas J, et al. Regional delivery of mesothelin-targeted CAR T cell therapy generates potent and long-lasting CD4-dependent tumor immunity. Sci Transl Med 2014;6:261ra151. [Crossref] [PubMed]
- O'Rourke DM, Nasrallah MP, Desai A, et al. A single dose of peripherally infused EGFRvIII-directed CAR T cells mediates antigen loss and induces adaptive resistance in patients with recurrent glioblastoma. Sci Transl Med 2017;9: [Crossref] [PubMed]
- Morello A, Sadelain M, Adusumilli PS. Mesothelin-targeted CARs: driving T cells to solid tumors. Cancer Discov 2016;6:133-46. [Crossref] [PubMed]
- Wilkie S, Picco G, Foster J, et al. Retargeting of human T cells to tumor-associated MUC1: the evolution of a chimeric antigen receptor. J Immunol 2008;180:4901-9. [Crossref] [PubMed]
- Robbins PF, Morgan RA, Feldman SA, et al. Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-1. J Clin Oncol 2011;29:917-24. [Crossref] [PubMed]
- Zacharakis N, Chinnasamy H, Black M, et al. Immune recognition of somatic mutations leading to complete durable regression in metastatic breast cancer. Nat Med 2018;24:724-30. [Crossref] [PubMed]
- Straathof KC, Bollard CM, Popat U, et al. Treatment of nasopharyngeal carcinoma with Epstein-Barr virus--specific T lymphocytes. Blood 2005;105:1898-904. [Crossref] [PubMed]
- Park JH, Rivière I, Gonen M, et al. Long-term follow-up of CD19 CAR therapy in acute lymphoblastic leukemia. N Engl J Med 2018;378:449-59. [Crossref] [PubMed]
- Zhang Q, Liu KQ, Liu BC, et al. Analysis of tumor lysis syndrome in 380 cases of acute leukemia. Zhongguo Shi Yan Xue Ye Xue Za Zhi 2015;23:61-4. [PubMed]
- Grupp SA, Kalos M, Barrett D, et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. N Engl J Med 2013;368:1509-18. [Crossref] [PubMed]
- Gust J, Taraseviciute A, Turtle CJ. Neurotoxicity associated with CD19-Targeted CAR-T cell therapies. CNS Drugs 2018;32:1091-101. [Crossref] [PubMed]
- Biomarkers on a roll. Nat Biotechnol 2010;28:431. [Crossref] [PubMed]
- Gnjatic S, Bronte V, Brunet LR, et al. Identifying baseline immune-related biomarkers to predict clinical outcome of immunotherapy. J Immunother Cancer 2017;5:44. [Crossref] [PubMed]
- Schumacher TN, Schreiber RD. Neoantigens in cancer immunotherapy. Science 2015;348:69-74. [Crossref] [PubMed]
- Blank CU, Haanen JB, Ribas A, et al. Cancer immunology. The “cancer immunogram”. Science 2016;352:658-60. [Crossref] [PubMed]
- Kalos M. Biomarkers in T cell therapy clinical trials. J Transl Med 2011;9:138. [Crossref] [PubMed]
- Fraietta JA, Schwab RD, Maus MV. Improving therapy of chronic lymphocytic leukemia with chimeric antigen receptor T cells. Semin Oncol 2016;43:291-9. [Crossref] [PubMed]
- Fraietta JA, Lacey SF, Orlando EJ, et al. Determinants of response and resistance to CD19 chimeric antigen receptor (CAR) T cell therapy of chronic lymphocytic leukemia. Nat Med 2018;24:563-71. [Crossref] [PubMed]
- Enblad G, Karlsson H, Gammelgård G, et al. A phase I/IIa trial using CD19-targeted third-generation CAR T cells for lymphoma and leukemia. Clin Cancer Res 2018;24:6185-94. [Crossref] [PubMed]
- Neelapu SS, Locke FL, Bartlett NL, et al. Axicabtagene ciloleucel CAR T-cell therapy in refractory large B-cell lymphoma. N Engl J Med 2017;377:2531-44. [Crossref] [PubMed]
- Porter DL, Hwang WT, Frey NV, et al. Chimeric antigen receptor T cells persist and induce sustained remissions in relapsed refractory chronic lymphocytic leukemia. Sci Transl Med 2015;7:303ra139. [Crossref] [PubMed]
- Chen JQ, Creasy C, Torres-Cabala CA, et al. Identification of predictive biomarker signatures in melanoma tumors associated with response to tumor-infiltrating lymphocyte (TIL) therapy. J Immunother Cancer 2013;1:48. [Crossref]
- Chen J, Creasy C, Torres-Cabala CA, et al. Predictive immune biomarker signatures in the tumor microenvironment of melanoma metastases associated with tumor-infiltrating lymphocyte (TIL) therapy. J Immunother Cancer 2014;2:243. [Crossref]
- Inozume T, Hanada K, Wang QJ, et al. Selection of CD8+PD-1+ lymphocytes in fresh human melanomas enriches for tumor-reactive T cells. J Immunother 2010;33:956-64. [Crossref] [PubMed]
- Ye Q, Song DG, Poussin M, et al. CD137 accurately identifies and enriches for naturally occurring tumor-reactive T cells in tumor. Clin Cancer Res 2014;20:44-55. [Crossref] [PubMed]
- Forget MA, Haymaker C, Hess KR, et al. Prospective analysis of adoptive TIL therapy in patients with metastatic melanoma: response, impact of anti-CTLA4, and biomarkers to predict clinical outcome. Clin Cancer Res 2018;24:4416-28. [Crossref] [PubMed]
- Radvanyi LG, Bernatchez C, Zhang M, et al. Specific lymphocyte subsets predict response to adoptive cell therapy using expanded autologous tumor-infiltrating lymphocytes in metastatic melanoma patients. Clin Cancer Res 2012;18:6758-70. [Crossref] [PubMed]
- Dudley ME, Wunderlich JR, Robbins PF, et al. Cancer regression and autoimmunity in patients after clonal repopulation with antitumor lymphocytes. Science 2002;298:850-4. [Crossref] [PubMed]
- Toh HC, Hopkins R, Ching QT, et al. Cellular immune biomarkers to prognosticate for survival to adoptive T-cell therapy in advanced nasopharyngeal cancer. J Clin Oncol 2017;35:6047. [Crossref]
- Klaver Y, van Steenbergen SCL, Sleijfer S, et al. Plasma IFN-γ and IL-6 levels correlate with peripheral T-cell numbers but not toxicity in RCC patients treated with CAR T-cells. Clin Immunol 2016;169:107-13. [Crossref] [PubMed]
- Maude SL. CAR emissions: cytokines tell the story. Blood 2017;130:2238-40. [Crossref] [PubMed]
- Brudno JN, Kochenderfer JN. Toxicities of chimeric antigen receptor T cells: recognition and management. Blood 2016;127:3321-30. [Crossref] [PubMed]

胡萌
中国人民解放军中部战区总医院肿瘤科。主治医师,医学博士,现任湖北省抗癌协会靶向治疗专委会青年委员,湖北省抗癌协会肿瘤热疗专委会委员,ESCO中西医结合肿瘤专家委员会委员。从事肿瘤内科专业多年,擅长消化系统肿瘤、淋巴瘤等内科诊疗,对肿瘤相关危重症具有一定的临床经验。承担院内课题1项,承担湖北省自然科学基金青年面上项目1项。(更新时间:2021/8/18)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Han S, Wang WW, Rozali E, Toh HC. Defining precision cellular immunotherapy—seeking biomarkers to predict and optimize outcomes of T cell therapies in cancer. Precis Cancer Med 2019;2:25.


